Contenido del Vídeo
Experimentalmente se sabe que la molécula de agua tiene geometría angular; en concreto, forma un ángulo de 104,5º. Aunque esta geometría la hemos predicho también de forma sencilla mediante el Modelo de repulsión de los pares electrónicos de la capa de valencia, RPECV, para que la geometría sea consistente con el enlace químico que presenta debemos profundizar un poco más y recurrir a la hibridación.
La configuración electrónica del oxígeno es:
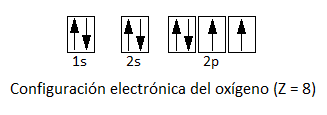
Así, vemos que no es necesario, como ocurría en el caso del átomo de carbono, la promoción de un electrón, pues el oxígeno ya presenta dos electrones desapareados con los que puede formar enlace covalente.
No obstante, si formase enlace con los dos orbitales p, que forman entre sí un ángulo de 90º, la molécula de agua también formaría un enlace de 90º. Como hemos dicho, se sabe que no es así. De hecho, el ángulo de la molécula de agua, 104,5º, es un ángulo cercano al de un tetraedro regular, 109,5º, aunque levemente distorsionado. Es por este motivo que debemos recurrir a una hibridación sp3 en la que intervendrán, por tanto, el orbital 2s y los 3 orbitales p. Se hibridarán el orbital 2s y el 2px a pesar de estar completos, dando lugar a 2 orbitales híbridos sp3 con un par de electrones libre y otros dos orbitales híbridos sp3 con un electrón desapareado, es decir:
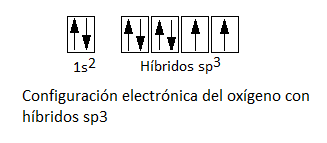
De esta forma, el oxígeno formará enlace covalente por solapamiento de los dos híbridos sp3 semillenos con los orbitales 1s de los oxígenos. Puesto que se tratará de un solapamiento frontal, se trata de enlaces de tipo sigma, σ (sp3-s). El ángulo no será de 109,5º porque los pares libres o no enlazantes ejercen una repulsión mayor sobre los pares enlazantes y distorionan este ángulo levemente. La geometría del agua según la hibridación sp3 se puede representar como:
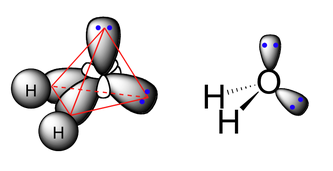
Imagen procedente de https://chemwiki.ucdavis.edu/
Category: Enlace Químico y Teoría de Enlace Químico.
Etiquetas: Enlace covalente, Geometría molecular e hibridación y Modelo enlace de valencia.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Hola Carmen! Enhorabuena por la página, está genial 🙂 Una pregunta, para nuestro nivel de 2º de bach. no nos pueden preguntar compuestos en los que hibriden todos los elementos que lo forman verdad? Muchas gracias!
Sofía, 12 Años Antes
¡Hola Sofía! Gracias por el comentario 🙂 En cuanto a lo de la hibridación, en principio dudo bastante que os pidan una molécula en la que hibride más de un átomo a no ser que sea simplemente un enlace doble, donde los dos carbonos hibridarán sp2, o enlace triple, donde hibridarán sp.
No obstante sí que os podrían pedir una molécula orgánica pequeña que tenga oxígenos, como por ejemplo el metanol, CH3OH, donde el carbono será sp3 (tetraédrico, 4 enlaces simples) y el oxígeno sp3 también (dos pares enlazantes C-O-H, y dos pares libres igual que en el agua) o bien alguna molécula con un enlace doble C=O donde tanto el carbono como el oxígeno tendrían que hibridar sp2 para tener cada uno de ellos un orbital p libre con el que formar el doble enlace. Esto es lo máximo de lo máximo, creo yo, más de eso no y ya es un pelín más rebuscado.
QuimiTube, 12 Años Antes
Carmen y no podriamos plantear en el doble enlace C=O que el carbono sí que tuviera una hibridacion sp2 y el oxigeno no hibridara y formara un enlace sigma sp2-p y un enlace pi p-p con el carbono?Muchisimas gracias otra vez! 🙂
Sofía, 12 Años Antes
Sí, realmente con ese planteamiento yo creo que te lo pondrían bien sin problemas.
Quimitube, 12 Años Antes
Gracias tia! eres una crack!!!!soy fan tuya haber si vienes a mi uni a explicarlo asi de bien 😉
Flavia, 12 Años Antes
Jajaja, mil gracias Flavia 😀 ¿Cuál es tu universidad? A mí si me contratan voy jajaja
QuimiTube, 12 Años Antes
Ojalaaa nuestra profesora de quimica explicara como usted!!! gracias a este video entinendo la hibridación y podremos aprobar el examen de enlaces!!!! GrACIAS MAQUINA!!!
Carolina y Maria, 12 Años Antes
Jajaja, ¡gracias chicas! Me hace mucha ilusión vuestro comentario, muchísima suerte con vuestro examen!
QuimiTube, 12 Años Antes
Hola Profe! la verdad tengo que agradecerte inmensamente! aprobé mi primer parcial gracias a ver tus videos! voy por mi segundo parcial y me quedaron claros algunos temas gracias a los videos.
tengo solo una duda.. como se cuando un átomo «hibridiza»? todos lo hacen? a veces me preguntan si el átomo central hibridiza o no. como haces a darte cuenta de eso?
desde ya muchisimas gracias!
Mateo, 11 Años Antes
¡Hola Mateo! Me alegro mucho de tu aprobado, seguro que también te irá bien en el segundo 🙂
En cuanto a la hibridación, lo cierto es que no es fácil plantearlo, pero lo habitual es que siempre el átomo central tenga hibridación. Lo que ocurre es que es más normal plantear hibridaciones en átomos sencillos, como carbono, nitrógeno u oxígeno, que sólo hibridan orbitales s y p. Pero también puedes tener hibridaciones más complejas, como por ejemplo sp3d, donde se estarán hibridando 5 orbitales atómicos.
QuimiTube, 11 Años Antes
Infinitas gracias profe..he aprobado mi segundo examen! realmente muchisimas gracias!!!!! 😀 he superado química 1 sin rendir examen final! estoy infinitamente agradecido!
Mateo, 11 Años Antes
¡Bien! ¡Enhorabuena! Me alegro muchísimo 😀
QuimiTube, 11 Años Antes
¡¡¡Muchas gracias por esta página!!! En segundo de bachiller a pesar de que me fue bien no llegué a entender la hibridación. Con los vídeos lo he comprendido a la perfección! Un abrazo de un estudiante de química farmacéutica contento!
Tony, 11 Años Antes
Hola Tony, no sé qué me alegra más, tu comentario en sí o que tú estés contento de haber comprendido la hibridación jejeje, me alegra mucho que algo así te alegre, porque nuestro objetivo es hacer la química más comprensible a la vez que amena. Un saludo muy grande, y ¡ánimo con la carrera!
QuimiTube, 11 Años Antes
¡Hola Carmen! me pareció muy bueno el vídeo y te felicito por tu pagina. Solo me quedo una duda: ¿La Geometría de la molécula del agua se Considera tetraedral ya que tiende a esto o mas bien trigonal piramidal?
Muchas Gracias y Saludos
Simón, 11 Años Antes
Hola Simón:
Debemos distinguir entre la disposición de los pares electrónicos y la geometría final de la molécula. La molécula de agua tiene 4 pares electrónicos en torno al oxígeno, que se dispondrán de forma tetraédrica. Sin embargo, finalmente la molécula será angular, porque has de tener en cuenta solo dos enlaces para determinar la geometría.
QuimiTube, 11 Años Antes
Me has salvado!!! Benditas sean las personas como tú que dedican su tiempo a que los demás entiendan mejor fyq :’)
Anna, 11 Años Antes
Y benditas las personas que dejan comentarios de apoyo como el tuyo, ¡gracias!
QuimiTube, 11 Años Antes
Buenas, ¿sera que por estos angulos se podria explicar el porque el agua es monodentada, es decir, solo puede donar un par de electrones libres porque el otro par estaria casi al otro extremo?.
Muchas gracias.
yosi, 10 Años Antes
¡Hola! Sí, no me parece una mala explicación. Un saludo.
QuimiTube, 10 Años Antes
Hola profe! Los dos pares de electrones no enlazantes se encuentran en el plano sp3??
Paola, 10 Años Antes
Entre ellos sí se encontrarán en el mismo plano, aunque globalmente (los dos enlazantes y los dos no enlazantes) formarán un tetraedro.
QuimiTube, 10 Años Antes
Hola te quisiera consultar, como seria la hibridación de cada de los atomos por ejemplo: en el metoxi-propino y en el 3-amina-1-propino
Alberto, 9 Años Antes
Hola Alberto, en aquellos carbonos que presenten todos los enlaces simples la hibridación será sp3, en el caso de los que presenten doble enlace y 2 enlaces simples, sp2, y si presentan triple enlace o dos enlaces dobles, sp. En cuanto a los otros átomos, el nitrógeno por ejemplo tendrá hibridación sp3 (como el amoníaco, ya que el grupo amino es análogo), o el oxígeno del metoxi tendrá hibridación sp3, como es en el caso del agua (es también análogo a esta molécula si te fijas). Un saludo.
QuimiTube, 9 Años Antes
Muy buena explicación. Genia. Segui así. Gracias. Saludos desde Argentina.
Mauricio, 9 Años Antes
Hola Mauricio, bienvenido y muchas gracias por tu comentario. Un saludo.
QuimiTube, 9 Años Antes
Me encantaría que mi maestra se tomará la molestia de explicar como tú, saludos desde México.
Daphne, 9 Años Antes
Muchas gracias Daphne, me alegra que te gusten las explicaciones. Un saludo hasta México.
QuimiTube, 9 Años Antes
Muy buen contenido… Me aclaró muchas dudas!!
Aaa, 9 Años Antes
Me alegro mucho, un saludo grande!
QuimiTube, 9 Años Antes