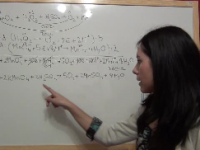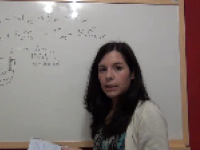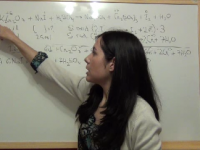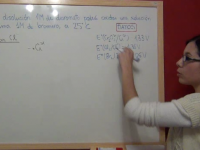Índice general de Redox: teoría y ejercicios
-

Ejercicio Química Selectividad PAU (junio 2014, Madrid): Valoración redox entre el peróxido de hidrógeno y el permanganato de potasio
Ejercicio resuelto de química de selectividad de Madrid, de junio de 2014. Es una valoración redox entre el peróxido de hidrógeno y el permanganato de potasio. Ver video -

Teoría Redox 1: Concepto de oxidación y de reducción
En este vídeo se explica con detenimiento y de forma comprensible qué se entiende por oxidación y qué se entiende por reducción, así como oxidantes y reductores. Ver video -

Teoría Redox 2: Definición de número oxidación y reglas de determinación del mismo
Definiremos el concepto de número de oxidación y explicaremos qué normas (convenio) se siguen para determinarlo en un compuesto. Ver video -

Ejercicio Redox 1: Ejemplos de determinación del número de oxidación de los átomos de algunos compuestos
En este ejercicio redox resuelto determinaremos el número de oxidación o estado de oxidación de algunos compuestos basándonos en las normas establecidas. Ver video -

Teoría Redox 3: Uso del número de oxidación para determinar qué elemento se oxida y qué elemento se reduce
Explicaremos teóricamente cómo se usa el número de oxidación o estado de oxidación para conocer la semirreacción de oxidacion y la semirreacción de reducción. Ver video -

Ejercicio Redox 2: uso del número de oxidación para saber qué elemento se reduce y qué elemento se oxida
Usaremos el número de oxidación o estado de oxidación para determinar qué especie se está oxidando y qué especie se está reduciendo. Ver video -

Ejercicio 3: Ajuste de la reacción redox en medio ácido entre el cobre, Cu, y el ácido nítrico, HNO3, con NO como producto
En este ejercicios ajustaremos una reacción de oxidación reducción en medio ácido entre el cobre metálico y el ácido nítrico, produciéndose NO. Ver video -

Ejercicio 4: Ajuste reacción redox en medio ácido Cu + HNO3 en la que se obtiene NO2 como producto
En este ejercicio ajustaremos la reacción de oxidación reducción en medio ácido entre el cobre y el ácido nítrico en la que se produce NO2. Ver video -

Ejercicio 5: Ajuste reacción redox medio ácido de cobre con nítrico, con dos productos de reducción: NO y NO2
En este ejercicio ajustaremos la reacción de cobre con ácido nítrico, pero con una particularidad: se producen dos productos de reducción, NO y NO2. Ver video