Índice general de Enlace Químico: teoría y ejercicios
-

Introducción al enlace químico: ¿Por qué se enlazan los átomos?
En este vídeo responderemos a la pregunta: ¿Por qué se enlazan los átomos? Como veremos, esencialmente se trata de una cuestión energética. Ver video -

Ejercicio Enlace Químico 1: Determinación del tipo de enlace entre dos elementos a partir de sus configuraciones electrónicas
En este ejercicio 1 de Enlace Químico determinaremos el tipo de enlace que se dará entre dos elementos a partir de las configuraciones electrónicas de los mismos. Ver video -
Enlace Químico Ejercicio 2: Determinación del tipo de enlace de dos elementos con configuraciónes Z+1 y Z-1, siendo Z argón
En este ejercicio 2 de Enlace Químico determinaremos el tipo de enlace entre dos elementos A y C sabiendo que sus números atómicos son Z+1 y Z-1. Ver video -

Ejercicio Enlace Químico 3: Determinación del tipo de enlace a partir de los números cuánticos n y l del último electrón
En este ejercicio 3 de Enlace Químico vamos a determinar el tipo de enlace que se podrá establecer entre varios elementos sabiendo los números cuánticos n y l del último electrón. Ver video -

Enlace covalente: regla del octeto y estructuras de Lewis
En este vídeo explicaremos en qué consiste el enlace covalente, así como la regla del octeto y las estructuras de Lewis empleadas para representar moléculas. Ver video -

Enlace covalente coordinado o dativo
En esta entrada hablaremos de un tipo especial de enlace covalente: el enlace covalente coordinado o dativo, en el que un solo átomo aporta el par de electrones. Ver video -

Enlace covalente: excepciones a la regla del octeto
Si bien la regla del octeto es muy útil para predecir la estructura de Lewis de moléculas sencillas, existen excepciones por defecto (BF3) y por exceso (PCl5) Ver video -

Ejercicio Enlace Químico 4: Estructuras de Lewis de algunas moléculas covalentes sencillas (sin resonancia)
En este ejercicio determinaremos la estructura de Lewis de algunas moléculas sencillas sin resonancia: H2O, NH3, CO, H2S, N2, BF3, HCN, ICl3, PCl3, SF6 y BeCl2 Ver video -

Enlace covalente: concepto de resonancia o mesomería
Algunas moléculas son híbridos de resonancia o formas mesómera, es decir, sus propiedades reales se corresponden a una molécula intermedia entre varias estructuras de Lewis. Ver video -

Ejercicio Enlace Químico 5: Estructuras de Lewis de algunas moléculas con resonancia: O3, CO2, N2O, NO y NO2
En este ejercicio resuelto de enlace químico determinaremos las estructuras de Lewis de algunas moléculas que presentan resonancia, como el ozono, el dióxido de carbono y algunos óxidos de nitrógeno. Ver video -

Enlace Químico Ejercicio 6: Estructuras de Lewis de los oxoácidos del cloro
En este ejercicio determinaremos las estructuras de Lewis de los oxoácidos del cloro, es decir, ácido hipocloroso, cloroso, clórico y perclórico. Ver video -

Enlace Químico Ejercicio 7: Estructuras de Lewis de aniones hipocloroso, nitrito, nitrato, sulfito, carbonato y sulfato
En este ejercicio determinaremos las estructuras de Lewis de algunos aniones: hipocloroso, silicato, nitrito, nitrato, carbonato, sulfito y sulfato. Ver video -

Enlace Químico Ejercicio 8: Estructuras de Lewis especies orgánicas (metanol, etanol, benceno, acetato, acetona)
En este ejercicio de enlace químico determinaremos las estructuras de Lewis de algunas especies orgánicas (metanol, etanol, benceno, acetato, acetona). Ver video -

Enlace químico: curvas de estabilidad energética o curvas de Morse
Un modo de visualizar las características energéticas de los enlaces químicos es a partir de las llamadas curvas de estabilidad energética o curvas de Morse. Ver video -

Enlace Químico Ejercicio 9: Cálculo del porcentaje de carácter iónico con el momento dipolar y la distancia de enlace
En este ejercicio calcularemos el % de carácter iónico de varios enlaces a partir de sus momentos dipolares y sus distancias de enlace. Ver video -

Enlace Químico Ejercicio 10: Cálculo del porcentaje de carácter iónico con la diferencia de electronegatividades
En este ejercicio vamos a calcular el porcentaje de carácter iónico de compuestos a partir de las diferencias de electronegatividad con una fórmula empírica. Ver video -

Enlace Químico ejercicio 11: determinación de la covalencia de flúor, cloro, nitrógeno y fósforo
En este ejercicio determinaremos las posibles covalencias de cuatro elementos, el flúor, el cloro, el nitrógeno y el fósforo con sus configuraciones electrónicas. Ver video -

Enlace covalente: polaridad de enlace y polaridad molecular
La polaridad de un enlace químico se da cuando existe una distribución asimétrica de la nube electrónica del enlace en torno a los dos átomos que forman dicho enlace. Ver video -

Parámetros moleculares: energía de enlace, longitud de enlace y ángulo de enlace
Entre los parámetros moleculares hallamos: la energía de enlace, la longitud de enlace (o distancia de enlace), el ángulo de enlace y la polaridad. Ver video -

Geometría molecular: modelo de repulsión de los pares electrónicos de la capa de valencia, RPECV
El modelo RPECV indica que la geometría de la especie química considerada será aquella que permita minimizar las repulsiones entre los pares electrónicos. Ver video -

Enlace Químico ejercicio 12: geometría de algunas moléculas por RPECV e hibridación
Determinaremos las estructuras de Lewis, la geometría por repulsión de pares electrónicos de la capa de valencia y también determinaremos la hibridación Ver video -

Enlace covalente: Modelo del Enlace de valencia
Este modelo se basa en que el enlace covalente se da cuando dos orbitales atómicos semiocupados penetran entre sí y los espines electrónicos se aparean. Ver video -

Enlace covalente: Introducción a la hibridación de orbitales atómicos
Hibridación de orbitales atómicos fue postulada por Pauling en el 1931 para poder explicar la geometría experimental determinada para algunas moléculas. Ver video -

Modelo de enlace de valencia. Hibridación sp sin enlaces múltiples: ejemplo del BeCl2
El orbital 2s y el orbital 2p del berilio se hibridan (se mezclan) para dar dos orbitales iguales que llamamos híbridos sp. Los 2 híbridos sp son equivalentes. Ver video -

Modelo del enlace de valencia. Hibridación sp2 con enlaces simples, BF3
Los tres orbitales atómicos , el s y los 2 orbitales p, se hibridan o combinan entre sí para dar 3 orbitales híbridos sp2, equivalentes en forma y en energía. Ver video -

Modelo del enlace de valencia. Hibridación sp3 del carbono en el metano y el etano
Los 4 orbitales atómicos, el 2s y los 3 orbitales p, se hibridan (se combinan) para dar 4 orbitales híbridos sp3. Ver video -

Modelo del enlace de valencia. Hibridación sp3 del nitrógeno en el amoniaco.
Se obtendrán 4 orbitales híbridos sp3 equivalentes y dirigidos hacia los vértices de un tetraedro. Uno de los híbridos sp3 albergará un par de electrones libre. Ver video -

Modelo del enlace de valencia. Hibridación sp3 del agua.
En el agua se hibridarán el orbital 2s y los orbitales 2p, dando lugar a 2 orbitales híbridos sp3 con un par de electrones y otros dos con un electrón desapareado Ver video -

Modelo del enlace de valencia. Hibridación sp2 con enlaces dobles carbono-carbono: eteno.
En el caso de los dobles enlaces carbono carbono se hibridan el orbital 2s con 2 de los orbitales p. El otro p permanece sin hibridar para formar el enlace doble. Ver video -

Modelo del enlace de valencia. Hibridación sp con enlaces triples carbono-carbono: etino.
Puesto que se deben formar 2 enlaces pi de solapamiento lateral, 2 orbitales p quedan sin hibridar y la hibridación es de tipo sp, es decir, lineal (180º). Ver video -

Modelo del enlace de valencia. Hibridación sp2 con enlaces pi deslocalizados: benceno
La molécula es plana, los ángulos son de 120º y todos los enlaces son iguales, debido a una hibridación sp2 de los 6 átomos, pero con enlaces pi deslocalizados. Ver video -

Enlace Químico ejercicio 13: Tipo de hibridación de los átomos de una molécula orgánica
En este ejercicio de enlace químico vamos a determinar el tipo de hibridación que presentan los átomos de una molécula orgánica, en concreto los de carbono y boro. Ver video -

Enlace Químico ejercicio 14: hibridación y parámetros de enlace del fosgeno, COCl2
En este ejercicio determinaremos la hibridación del átomo central de la molécula de fosgeno, COCl2, así como la distancia y el ángulo de enlace relativos. Ver video -

Enlace Químico ejercicio 15: determinación de la geometría y la hibridación del ión oxonio, H3O+, y del amonio, NH4+
En este ejercicio determinaremos las estructuras de Lewis de los iones amonio y oxonio, así como su geometría y la hibridación del átomo central. Ver video -

Enlace Químico ejercicio 16: hibridación y parámetros de enlace del difluoruro de oxígeno, F2O
En este ejercicio determinaremos la hibridación y los parámetros de enlace, así como la geometría, de la molécula de difluoruro de oxígeno, F2O. Ver video -

Enlace Químico ejercicio 17: Determinar la polaridad de los enlaces de la 3-cloro-2-butanona
En este ejercicio vamos a determinar la polaridad de algunos enlaces de una molécula orgánica, la 3-cloro-2-butanona, además de la densidad de carga. Ver video -

Enlace Químico ejercicio 18: Enlaces polarizados y densidad de carga del 2-cloropropeno
En este ejercicio de enlace químico vamos a formular el compuesto 2-cloropropeno y vamos a determinar cuáles son los enlaces polarizados que presenta. Ver video -

Enlace Químico ejercicio 19: Rotación o rigidez de los enlaces carbono-carbono
En este ejercicio de carácter teórico determinaremos por qué un enlace simple C-C tiene cierta libertad de giro, mientras que los enlaces múltiples son rígidos. Ver video -

Introducción al enlace metálico: modelo del mar de electrones o del gas electrónico
En esta teoría, los cationes se empaquetan y los electrones de valencia se mueven con libertad. Estos electrones no pertenecen ya a los átomos individuales. Ver video -

Enlace metálico: teoría de bandas
En este vídeo explicaremos de forma sencilla la teoría de bandas, que permite explicar propiedades de conductividad de metales, aislantes y semiconductores. Ver video -

Propiedades de los metales
Los metáles son duros, dúctiles y maleables, y presentan una elevada conductividad eléctrica y térmica. Además, son densos y presentan elevados puntos de fusión. Ver video -

Enlace Químico ejercicio 20: Conductividad eléctrica del sodio y el berilio por teoría de bandas
En este ejercicio determinaremos el porqué de la conductividad del sodio (alcalino) y del berilio (alcalinotérreo) a partir de la teoría de bandas. Ver video -

Enlace Químico ejercicio 21: cuestiones de verdadero falso sobre el enlace metálico
En este ejercicio responderemos una serie de cuestiones de verdadero o falso sobre el enlace metálico. Ver video -

Fundamentos del enlace iónico y tipos de redes cristalinas
El enlace iónico se da entre cationes y aniones, que se unen entre sí por atracción electrostática, formando una red cristalina altamente ordenada. Ver video -

Cálculo de la energía reticular a partir de la ecuación de Born Landé
La ecuación de Born-Landé permite el cálculo de la energía reticular de un compuesto iónico a partir de una serie de parámetros cristalinos. Ver video -

Enlace Químico ejercicio 22: cálculo de la energía reticular de AB por la ecuación de Born-Landé
En este ejercicio vamos a determinar la energía reticular desprendida cuando se forma un mol de compuesto AB, a partir de la ecuación de Born-Landé. Ver video -

Enlace Químico Ejercicio 23: Comparación de la dureza de dos compuestos iónicos por la ecuación Born-Landé
En este ejercicio determinaremos qué compuesto presenta mayor dureza, KBr o NaBr, usando de forma cualitativa la ecuación de Born-Landé para la energía reticular. Ver video -

Enlace Químico ejercicio 24: Determinar cómo afectan ciertas variaciones a la energía reticular de AB con Born-Landé
En este ejercicio determinaremos cómo afecta el cambio en la carga de los iones o en las distancias interiónicas de AB en la energía reticular del compuesto. Ver video -

Enlace Químico ejercicio 25: Energía reticular y punto de fusión de NaF, KF, LiF y NaF, NaCl, NaBr
En este ejercicio determinaremos el compuesto iónico de menor punto de fusión y de mayor energía reticular de un grupo que difiere en el catión o en el anión. Ver video -

Enlace Químico ejercicio 26: Ordenar de mayor a menor energía reticular KI, CaS, KF y CaO
En este ejercicio ordenaremos cualitativamente de mayor a menor energía reticular los compuestos CaS, CaO, KI y KF. Ver video -

Ciclo de Born Haber para el cálculo de la energía reticular
El Ciclo de Born-Haber se basa, esencialmente, en desglosar el proceso global en un conjunto de procesos parciales. Ver video -

Enlace Químico ejercicio 27: Ciclo de Born Haber para el fluoruro sódico, NaF
En este ejercicio responderemos una serie de cuestiones sobre las energías implicadas en el ciclo de Born-Haber para el fluoruro sódico. Ver video -

Enlace Químico ejercicio 28: Cálculo de la energía reticular del fluoruro de calcio, CaF2 por Born Haber y Born Landé
En este ejercicio calcularemos la energía reticular del CaF2 de dos formas distintas: mediante el ciclo de Born-Haber y mediante la ecuación de Born-Landé. Ver video -

Enlace Químico ejercicio 29: Cálculo de la energía reticular del bromuro potásico, KBr, por el Ciclo de Born Haber
En este ejercicio determinaremos la energía reticular del bromuro potásico, KBr, planteando el Ciclo de Born-Haber para su formación. Ver video -

Enlace Químico ejercicio 30: Cálculo de la energía reticular del óxido de magnesio, MgO, por el Ciclo de Born Haber
En este ejercicio determinaremos la energía reticular del óxido de magnesio, MgO, a partir del uso del Ciclo de Born-Haber. Ver video -

Enlace Químico ejercicio 31: Cálculo de la afinidad electrónica del cloro por el Ciclo de Born Haber
En este ejercicio determinaremos la afinidad electrónica del cloro a partir del ciclo de Born-Haber para el cloruro sódico. Ver video -

Enlace Químico ejercicio 32: Demostrar la no existencia del compuesto NaO con el Ciclo de Born Haber
En este ejercicio demostraremos que no existe el compuesto NaO, es decir, con el sodio divalente Na(2+), mediante el uso del Ciclo de Born-Haber. Ver video -

Propiedades de los compuestos iónicos
Los compuestos iónicos forman redes cristalinas a temperatura ambiente, que presentan altos puntos de fusión y ebullición, elevada dureza y son solubles en agua. Ver video -

Introducción a las propiedades de los compuestos covalentes
Los compuestos covalentes se dividen en dos tipos: las sustancias covalentes moleculares y las redes covalentes o cristales covalentes. Ver video -

Propiedades de las sustancias covalentes moleculares
Las sustancias covalentes moleculares están formadas por moléculas individuales que únicamente establecen entre sí fuerzas débiles, las fuerzas intermoleculares. Ver video -

Propiedades de las redes covalentes: estructuras del diamante y del grafito
Las redes covalentes son sustancias macromoleculares, formadas por un número muy elevado de átomos unidos entre sí por enlaces covalentes, es decir, muy fuertes. Ver video -

Introducción a las fuerzas intermoleculares
En este vídeo introduciremos el concepto de fuerzas intermoleculares entre moléculas covalentes, distinguiendo dos tipos en función de la polaridad molecular. Ver video -

Fuerzas de London o de dispersión: dipolo instantáneo - dipolo inducido
Las fuerzas de London, también conocidas como dipolo instantáneo-dipolo inducido, se dan entre moléculas covalentes apolares y se trata de fuerzas débiles. Ver video -
Enlaces de hidrógeno y fuerzas de van der Waals
Cuando tenemos moléculas covalentes polares, que forman dipolos permanentes, éstas se atraerán mutuamente mediante fuerzas intermoleculares de tipo electrostático. Ver video -
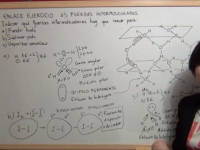
Enlace Químico ejercicio 35: Determinar las fuerzas intermoleculares que hay que vencer para fundir hielo, sublimar yodo y vaporizar NH3
En este ejercicio vamos a determinar qué fuerzas intermoleculares hay que vencer para fundir hielo, sublimar yodo sólido y vaporizar amoníaco líquido. Ver video -

Enlace Químico ejercicio 33: Determinar qué compuestos del grupo presentan enlace de hidrógeno
En este ejercicio determinaremos qué compuestos de un grupo presentarán enlace de hidrógeno: HF, H2O, CH3CH2OH, CH3NH2, H2O2, NH3, CH3OCH3, PH3 y CH3COOH. Ver video -

Enlace Químico ejercicio 34: Determinar la polaridad, contribución iónica y enlace de hidrógeno de H2O, HF, H2, CH4 y NH3
En este ejercicio responderemos una serie de cuestiones acerca de un grupo de moléculas covalentes de distinta polaridad: HF, H2O, H2, CH4 y NH3 Ver video -

Enlace Químico ejercicio 36: fundir cloruro potásico, hervir agua y disolver yodo en benceno
En este ejercicio determinaremos qué fuerzas intermoleculares o enlaces hay que vencer para hervir agua, disolver yodo en benceno o fundir cloruro potásico. Ver video -

Enlace Químico ejercicio 37: Propiedades físicas del cobre, el dióxido de carbono y el fluoruro de cesio
En este ejercicio consideraremos, en función del tipo de enlace químico, qué propiedades presentarán el cobre, el dióxido de carbono y el fluoruro de cesio. Ver video -

Enlace Químico ejercicio 38: Razonar ciertos hechos experimentales, Cl2 y KCl, NaF y F2, Ag y AgCl
En este ejercicio debemos determinar por qué el KCl funde a alta temperatura y el Cl2 es un gas, también en el caso del NaF y el F2 y la conductividad de Ag y AgCl. Ver video -

Enlace Químico Ejercicio 39: Solubilidad de yodo y cloruro potásico en agua y tetracloruro de carbono
En este ejercicio determinaremos la solubilidad de yodo y cloruro potásico en dos disolventes, uno polar, el agua y uno apolar, el tetracloruro de carbono. Ver video -

Enlace Químico ejercicio 40: Propiedades de las redes cristalinas BaCl2, H2O, Diamante e I2
A la temperatura de 0ºC, el cloruro de bario, el agua, el diamante y el yodo son sólidos, pero redes cristalinas es distinta. ¿Qué tipos de redes forman? Ver video -

Enlace Químico ejercicio 41: Asignación de redes cristalinas: metal, compuesto iónico, red covalente o sólido molecular
Asignar en función de las propiedades de ciertas sustancias a qué tipo de red cristalinas pertenecerá cada una de ellas. Ver video -

Enlace Químico ejercicio 42: Deducir de qué sustancia se trata en base a las propiedades
En este ejercicio, partiendo de un conjunto de sustancias y de ciertas descripciones de sus propiedades físicas, debemos emparejarlas. Ver video -

Enlace Químico ejercicio 43: Justificar los puntos de ebullición del etano, dimetiléter y etanol
En este ejercicio vamos a justificar razonadamente las diferencias en los puntos de ebullición de tres compuestos orgánicos: el etano, el dimetiléter y el etanol. Ver video -

Enlace Químico ejercicio 44: Puntos de ebullición de los compuestos de hidrógeno de halógenos y anfígenos
Justificaremos los puntos de ebullición de los distintos compuestos que son combinación del hidrógeno con distintos halógenos y con anfígenos. Ver video -

Enlace Químico ejercicio 45: Ordenar por puntos de ebullición etanol, butano, agua y metano
En este ejercicio debemos ordenar los puntos de ebullición de diversas moléculas deduciendo a partir de las fuerzas intermoleculares que éstas presentan. Ver video -

Enlace Químico ejercicio 46: Asignar puntos de fusión a nitrógeno, aluminio, diamante y tricloruro de boro
En este ejercicio debemos asignar los puntos de fusión 3550ºC, 650ºC, -107ºC y -196ºC a los compuestos nitrógeno, aluminio, diamante y tricloruro de boro. Ver video




