Contenido del Vídeo
Hemos visto en apartados previos que en una reacción química hay dos fuerzas impulsoras diferenciadas. Por una parte, se ve favorecido el sentido de la reacción en el que hay una disminución de entalpía de reactivos a productos, es decir, el sentido exotérmico, mientras que, por otra parte, se favorece el sentido de la reacción en el que hay un aumento de entropía, ΔS > 0, es decir, un aumento del desorden. De ambos factores, ΔH y ΔS, dependerá que una reacción química sea espontánea o no espontánea. Ambos factores pueden ir en el mismo sentido o estar contrapuestos, teniendo tres posibles situaciones distintas:
1) Puede ser que tanto ΔH como ΔS sean favorables, con lo cual la reacción será en todo caso espontánea, independientemente de la temperatura.
2) Puede ser, por el contrario, que tanto ΔH como ΔS sean desfavorables, con lo cual la reacción será no espontánea a cualquier temperatura.
3) Puede ser que una de las dos variables sea favorable y la otra desfavorable, con lo cual el resultado final dependerá de la magnitud de ambos, es decir, de cuál de estas dos fuerzas impulsoras contrapuestas tenga mayor peso en el resultado final, así como de la temperatura.
Estas tres posibles situaciones hacen pensar que debe haber una relación matemática entre la entalpía y la entropía, dependiente de la temperatura, que las combine ambas y nos sirva para predecir la espontaneidad o no espontaneidad de una reacción química. Aunque no vamos a deducir dicha relación, es una nueva magnitud, llamada Energía Libre de Gibbs, que viene dada por la expresión siguiente:
G = H – TS
G es una función de estado extensiva (depende únicamente del estado inicial y final y de la cantidad total de materia que contenga el sistema considerado). Si estamos considerando una reacción química, en la que pasamos de unos reactivos a unos productos, la expresaremos como incrementos:
ΔG = ΔH – TΔS
El factor de entalpía, ΔH, representa la energía total del sistema, mientras que el factor TΔS representa la energía no aprovechable de dicha energía total, es decir, energía que el sistema no puede utilizar para realizar un trabajo. Por esto a ΔG se la llama energía libre o entalpía libre, porque es la fracción o la cantidad de la energía total que sí puede ser aprovechable como trabajo útil. Por este motivo es dicha magnitud, y no la entalpía ni la entropía, el factor determinante de la espontaneidad de una reacción química, ya que representa la energía efectivamente disponible en procesos realizados a presión y temperatura constante. Así, en función del signo de la variación de energía libre de Gibbs, tenemos tres posibilidades:
ΔG > 0, positivo: Reacción no espontánea
ΔG = 0, Sistema en equilibrio
ΔG < 0, negativo: Reacción espontánea
Teniendo en cuenta la expresión matemática considerada, podemos establecer el signo de la variación de energía libre de Gibbs de forma cualitativa conociendo los signos de la variación de entalpía y de la variación de entropía, ΔH y ΔS. Así, tendremos cuatro posibilidades distintas:
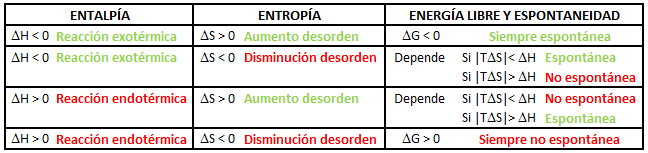
Te puede interesar:
Todos los vídeos de teoría de termoquímica
Todos los vídeos de ejercicios de termoquímica
Category: Teoría de Termoquímica y Termodinámica Química.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
muchas gracias me fue de mucha ayuda.
thankyou, 11 Años Antes
De nada, me alegro mucho 🙂
QuimiTube, 11 Años Antes
Carmen, un fallo técnico leve de la web. Si le das a «siguiente» en la página de termodinámica Teoría 20 te redirecciona a «ejercicio-termodinamica-26 […]».
Aprovecho agradeciendote por realizar estos magníficos vídeos que al parecer resultan muy útiles para la universidad y más si no has dado en 2ºBach. química. Un saludo.
Roberto, 11 Años Antes
Hola, gracias por los vídeos me han ayudado mucho a comprender los temas en la escuela.
A lo mejor este comentario no tiene que ver con el vídeo, :s pero no se si puedas hablar sobre equilibrio físico y dar algunos ejemplos y experimentos. Te lo agradesería mucho 😀
Eduardo Alonso, 11 Años Antes
Hola Eduardo, muchas gracias por tu comentario y bienvenido, me alegro que te sirva el material. No es probable que subamos nada de física, al menos por el momento, lo lamento.
QuimiTube, 11 Años Antes
En primer lugar felicitaciones por los vídeos, explicas muy bien y son bastante claros.
En cuanto al tema tratado en este apartado, cuando ∆H < 0 y ∆S < 0, cuanta más temperatura tengamos más se favorece la no espontaneidad.
Siempre había entendido que la T era directamente proporcional a S, cuanta más temperatura se tenía más energía tenían las partículas y eso se traducía en mayor S.
¿Por qué en este caso es al contrario?
¿Cómo transmitiendo más T aumenta el orden y ↓ S?.
Muchísimas gracias.
Un saludo.
Tomás, 11 Años Antes
Hola Tomás:
Muchas gracias por tu comentario, me alegra que te sirvan los vídeos.
En cuanto a tu pregunta, debemos diferenciar entre el valor en sí mismo de la entropía molar, que como bien has dicho aumentará con la temperatura (y esto siempre será así, para cualquier sustancia) y el factor o producto T·DS, que está restando en la expresión de la energía libre. De hecho, si en la reacción DS > 0 (aumento del desorden) un aumento de temperatura también favorece a la espontaneidad porque aumenta el factor T·DS, por lo que van en el mismo sentido.
QuimiTube, 11 Años Antes
Muchas gracias Carmen por tu rápida respuesta.
La verdad es que todavía no lo tengo claro.
Cojamos de los casos posibles el segundo que has puesto en el cuadro
∆H < 0 (exotérmica) y ∆S < 0 (disminuye el desorden)
Pongo un ejemplo con números pequeños e inventados para explicarme.
∆H = -6 ∆S = -4 T = 1
∆G = ∆H – T ∆S
∆G = -6 – [1 (-4)] = -6 + 4 = -2 espontánea
Aumentamos la temperatura T = 2
∆G = -6 – [2 (-4)] = -6 + 8 = 2 no espontánea
En este caso la entropía molar disminuye (aumenta el orden), por lo que tenderá a ser no espontánea.
Por lo que si tenemos una misma ∆H y una misma ∆S y lo único que variamos es la T; teniendo en cuenta que la S aumenta con la T, debería de aumentar S y por tanto el desorden.
Por lo que tenemos dos factores, aparentemente, contradictorios pero que en la fórmula se miltiplican con el mismo signo.
Si tenemos una reducción de S de -4, diciéndolo en palabras sencillas, hemos disminuido el desorden 4 unidades; pero si lo multiplicamos por la temperatura (por ejemplo 2), nos da -8, por lo que hemos duplicado la disminución del desorden, por lo tanto estará más ordenado. Parece que la T ordena.
Si en la reacción ∆S < 0 (disminución del desorden) un aumento de temperatura (aumentará el desorden) , parece que van en distinto sentido.
Perdona si no me explico del todo claro; son unos conceptos un poco difíciles de asimilar.
Muchas gracias por todo.
Un saludo
Tomás, 11 Años Antes
Lo que ocurre es que lo que aumenta con la temperatura es S (valor absoluto) de la entropía de las distintas sustancias que intervienen en la reacción. Sin embargo, la variación de entropía, DS, no tiene por qué aumentar siempre (aumentar el desorden neto) con la temperatura, ya que dependerá de diferentes factores: qué sustancias tengamos, qué estado de agregación presenten… Te pueden servir estos vídeos para entender la diferencia precisa entre S y DS y por qué el aumento de temperatura hace que aumente la primera, S, pero no tiene por qué aumentar la segunda, DS:
http://www.quimitube.com/videos/termodinamica-teoria-18-tercer-principio-de-la-termodinamica-entropia-molar-estandar/
http://www.quimitube.com/videos/termodinamica-teoria-19-1-como-calcular-la-variacion-de-entropia-de-una-reaccion-con-las-entropias-molares-estandar/
http://www.quimitube.com/videos/termodinamica-teoria-19-2-deduccion-cualitativa-del-signo-de-la-entropia-de-reaccion/
Por esto, como balance global, puede ocurrir que un aumento de la temperatura deje de favorecer la reacción, y de hecho es así en muchas reacciones que cumplen el caso que tú has puesto, es decir, que la entalpía sea negativa y la entropía positiva. Indicas:
«Si en la reacción ∆S < 0 (disminución del desorden) un aumento de temperatura (aumentará el desorden) , parece que van en distinto sentido." Efectivamente, si la reacción presenta una disminución del desorden neto (los productos son más ordenados que los reactivos) el aumento de la temperatura no favorece la reacción, sino al contrario. En estos casos el factor DS es desfavorable para la espontaneidad de la reacción, y cuanto mayor es el factor por el cual lo multiplicas, T, mayor va a ser su magnitud y menos favorable se hará la reacción. Mira, por ejemplo, el caso de la producción de amoníaco: http://www.quimitube.com/produccion-industrial-amoniaco-sintesis-de-haber-principio-le-chatelier/
En esta reacción ocurre exactamente eso, el aumento de T va en contra de la producción de amoníaco.
QuimiTube, 11 Años Antes
Después de ver todos los vídeos, más o menos lo he entendido.
Te agradezco tu respuesta.
Un saludo.
Tomás, 11 Años Antes
Muchas gracias por los vídeos. No subirás nada de cinética química?
Steffy, 11 Años Antes
¡Hola! Pues ya estoy preparando el índice general y los guiones de cinética, que es el próximo tema, pero como el trabajo me absorbe mucho tiempo no sé cuándo los podré grabar… Aún así si tienes dudas concretas de cinética me las puedes consultar, aunque aún no veas vídeos. Un saludo grande.
QuimiTube, 11 Años Antes
Explicas increíble, muchas gracias!
Isadora, 10 Años Antes
Muchas gracias a ti por comentar 🙂 Un saludo
QuimiTube, 10 Años Antes
Muchas gracias por estos vídeos, es un trabajo increible.
Solo quería hacer una pequeña aportación en relación con la notación en las fórmulas. En el caso ∆H 0, cuando se indica la condición |T∆S| < ∆H, debería usarse también el valor absoluto de ∆H, |T∆S| < |∆H|, ya que de lo contrario, como ∆H es negativo, se estaría indicando que un valor absoluto es menor que un número negativo.
Un saludo y enhorabuena otra vez por esta gran web.
Aurelio, 10 Años Antes
Hola Aurelio, tienes toda la razón, si uno lo piensa resulta incongruente. Un saludo grande y gracias por el comentario.
QuimiTube, 10 Años Antes
[…] si una reacción química es o no espontánea (como puedes ver explicado con mayor profundidad aquí). Y esta clasificación también tiene su propio nombre, aunque mucho menos utilizados que los de […]
Reacciones endergónicas y reacciones exergónicas | Quimitube, 10 Años Antes
Muchas gracias por tus explicaciones y videos, estoy cursando inorgánica en la universidad y cada vez que tengo oportunidad o dudas siempre recurro a tus videos. Me han sido de gran ayuda!!!
Melii, 10 Años Antes
Me alegra mucho que te sirvan y te agradezco que hayas dejado tu comentario. Un saludo grande.
QuimiTube, 10 Años Antes
Muy bueno, muchísimas gracias por esta pagina!! saludos, soy estudiante de biologia
alejandro, 10 Años Antes
Muchas gracias Alejandro y mucha suerte con tu carrera de biología.
QuimiTube, 10 Años Antes
muchas gracias!! me re sirvió energía libre,
soy profe de quimica de formosa, arentina.
saludos y excelente tu explicación
BEATRIZ, 10 Años Antes
¡Muchísimas gracias Beatriz! Disculpa la tardanza en mi respuesta, en ocasiones se me traspapelan comentarios. Un saludo.
QuimiTube, 9 Años Antes
genial! qué explicacion tan buena!
soy ingeniero trabajando en francia y me ha venido muy muy bien revisar las bases de quimica.
David, 10 Años Antes
Hola David, muchísimas gracias. Mucha suerte en tu andadura por Francia, un saludo grande.
QuimiTube, 10 Años Antes
Hola hola, me sirvió mucho tu explicación para unos temas de bioenergética que estoy viendo, estoy estudiando una maestría y esto me ayudó a entender mejor a relacionar los conceptos, sin embargo creo que te equivocaste en el pizarron al escribir el 3er caso, verdad? ya que no podría ser espontánea si DeltaH>0
¡Saludos desde México!
Rudy
Rudy, 9 Años Antes
Disculpa, ya lo corroboré, yo era el que lo estaba viendo mal! Muy bien explicado, muchas gracias!
Rudy, 9 Años Antes
Genial, un saludo grande.
QuimiTube, 9 Años Antes
Todo bien, sólo me quedó la duda de las unidades en que debe o puede estar la energía de Gibbs… 😀
Saraí, 8 Años Antes
¡Hola! Debe estar en kJ/mol, o es lo más habitual, como la entalpía. Un saludo.
QuimiTube, 8 Años Antes
Muchísimas gracias por la explicación! Mañana rindo un final de química general y tu explicación me ha dejado todo más que claro!! 🙂
Laura, 8 Años Antes
Espero que te fuese muy bien tu examen, un abrazo.
QuimiTube, 8 Años Antes