Contenido del Vídeo
La entalpía de formación es un tipo concreto de entalpía de reacción, que recibe el nombre de entalpía de formación estándar o entalpía normal de formación si la reacción se lleva a cabo a 25ºC y a 1 atm, que son las condiciones estándar en termoquímica. Así, la entalpía normal o estándar de formación (también llamada a veces calor normal de formación), se representa por ΔHof y es la variación de entalpía cuando se forma un mol de compuesto a partir de sus elementos en estado normal (esto es, en el estado de agregación y forma alotrópica más estable a la que dichos elemento se hallan en condiciones estándar).
Esta entalpía de formación podrá ser positiva, reacción endotérmica, o negativa, reacción exotérmica. Por ejemplo, es exotérmica la reacción de formación de peróxido de hidrógeno a partir de sus elementos, hidrógeno y oxígeno, en estado gaseoso, que es como se encuentran en condiciones estándar:
![]()
Mientras que la reacción de formación del eteno, C2H4, es endotérmica, es decir, absorbe calor cuando se produce:
![]()
Como vemos, en esta última reacción hemos indicado que el carbono, además de estar en estado sólido, está en forma de grafito. Esto se debe a que el carbono tiene distintas formas alotrópicas, es decir, compuestas por el mismo elemento pero con distintas estructuras, como el grafito y el diamante, pero la más estable a 25ºC y a 1 atmósfera de presión es el grafito, y por este motivo es esta la forma que debemos escoger para plantear las reacciones de formación en las que intervenga el carbono. Esta presentación de formas alotrópicas ocurre también en otros elementos, como el azufre, que puede presentar estructura monoclínica y rómbica, o el fósforo, que puede tener la llama estructura de fósforo blanco y la de fósforo rojo.
Asimismo, la entalpía de formación cambia si el compuesto formado está en distinto estado de agregación, aunque se parta de los mismos elementos. Por ejemplo, la entalpía de formación del agua vapor, del agua líquida y del agua sólida difieren:
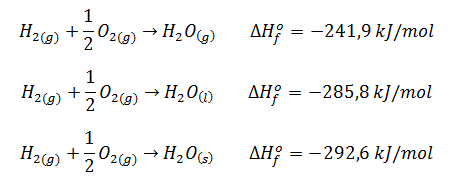
No obstante, lo habitual es plantear que se produce agua líquida si estamos en condiciones estándar, ya que es así como el agua se encuentra a 25ºC y 1 atmósfera de presión.
Cabe destacar, además, que la entalpía de formación de los elementos puros se toman como 0, pues como no podemos conocer los valores absolutos de entalpía, se toman estos como referencias arbitrarias. Así, por ejemplo:
ΔHof O2(g) = 0 kJ/mol
ΔHof Cl2(g) = 0 kJ/mol
ΔHof Na(s) = 0 kJ/mol
A continuación se muestra una tabla con los valores de entalpía de formación estándar de distintos compuestos, en kJ/mol, y con sus correspondientes estados de agregación.
Clicando sobre ella puedes descargarla como imagen, y en el enlace inferior puedes descargarla como PDF.
Tabla de valores de entalpías de formación estándar de diversos compuestos en PDF
Category: Teoría de Termoquímica y Termodinámica Química.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad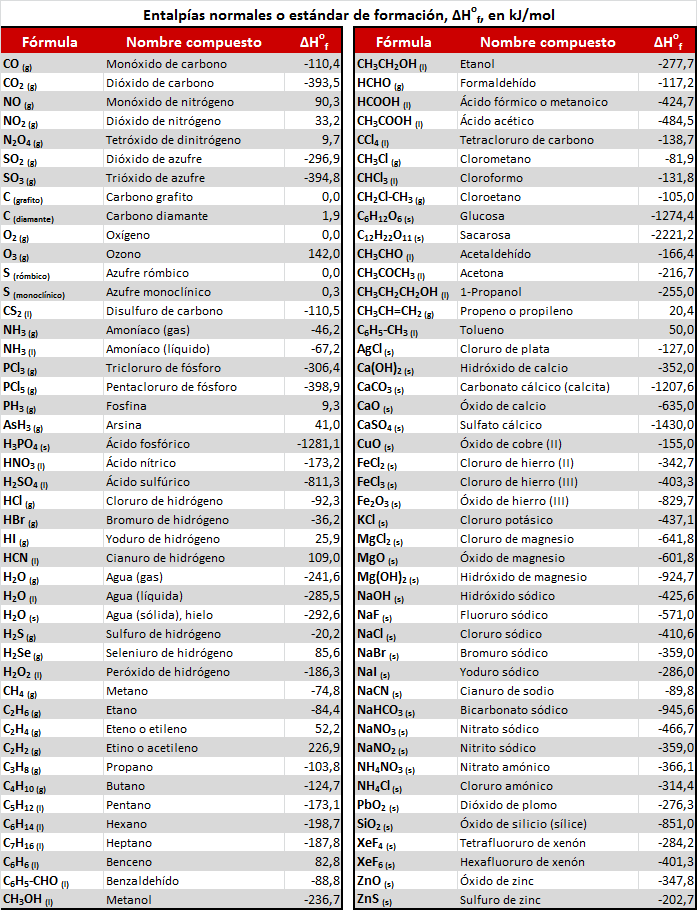
Muchas gracias por la clase me sirvió mucho. Saludos desde Perú
Imanol, 11 Años Antes
Muchas gracias Imanol, me alegro de que te sirviera, bienvenido 🙂
QuimiTube, 11 Años Antes
Excelente la explicación, desde Colombia.
Emiliano, 10 Años Antes
Muy bien! entendido! Gracias guapa!
Sachet, 11 Años Antes
¡De nada! Gracias a ti por tus comentarios de apoyo.
QuimiTube, 11 Años Antes
muy bueno gracias por ayudar …..muy buena explicacion ,
gaston, 11 Años Antes
Muchas gracias por tus vídeos, no tienes de cinética química ? Los he estado buscando y nada…
Steffy, 11 Años Antes
¡Hola! Gracias por tu comentario. No tengo de cinética química todavía, espero que lleguen pronto. Un saludo grande.
QuimiTube, 11 Años Antes
chicos me podrian explicar en si el termino enaltapia
andres, 11 Años Antes
¡Hola! Lo tienes en este vídeo:
http://www.quimitube.com/videos/termodinamica-teoria-7-concepto-entalpia-transferencia-calor-presion-constante/
Un saludo
QuimiTube, 11 Años Antes
eso era lo queria grax..!!
Renzo, 11 Años Antes
¡De nada!
QuimiTube, 11 Años Antes
No encuentro el valor de entalpía de formación del nitrato de plomo
Fonsy, 4 Años Antes
Hola! Si tienes acceso a alguna biblioteca universitaria te sugiero consultar un libro específico de Química Física, es donde es más probable que lo encuentres. Un saludo.
QuimiTube, 4 Años Antes
gracias por esto me ayudo mucho
the bubu, 11 Años Antes
De nada, me alegra que te haya servido. Un saludo.
QuimiTube, 11 Años Antes
tengo una duda con el signo de la entalpia de formacion del propeno o propileno. juzguen…!!!
henrry pacsi, 11 Años Antes
¡Hola! ¿Cuál es tu duda?
Aquí tienes la tabla de entalpías de formación: http://www.quimitube.com/wp-content/uploads/2013/04/tabla-entalpias-estandar-formacion-imagen.png y puedes ver que es positiva, es decir, la formación del compuesto no es favorable energéticamente.
QuimiTube, 11 Años Antes
Son de mucha utilidad tus vídeos ¡Gracias!
Jaír García, 11 Años Antes
De nada, gracias a ti por tu comentario 🙂
QuimiTube, 11 Años Antes
buenas tardes, podrían explicarme la solución del siguiente problema?
Sabiendo que el calor de combustión de H2(g) es -284.5 kj/mol, el calor de combustión del C(s) es -391.7 kj/mol, el calor de combustión del gas propano es -2210.8 kj/mol y el calor de hidrogenación del gas propeno es -123.3 kj/mol, todos a 25°C y 1 atm, y resultando liquida el agua que se pueda formar, calcula el calor de formación del propeno en las mismas condiciones.
3C(s) + 3H2(g) = CH3-CH=CH2(g)
ΔHf =
Jose, 11 Años Antes
Hola Jose:
Tienes que plantear las reacciones de combustión de cada uno de los compuestos que te indican y la de hidrogenación del propeno. Cuando hayas escrito todas las reacciones, junto con la última, que es de la que quieres calcular la entalpía de formación, podrás aplicar la fórmula que explicamos en este vídeo. Y el motivo por el que podrás aplicarla es porque la reacción de combustión del H2 es equivalente a la reacción de formación del agua (por tanto, -284,5 kJ/mol es la entalpía de formación del agua, y la reacción de combustión del C(s) es equivalente a la reacción de formación del CO2 (por tanto, -391,7 kJ/mol es la entalpía de formación del CO2). Un saludo.
QuimiTube, 11 Años Antes
Muy buena leccion, estoy estudiando termodinamica y no me quedaba muy claro el concepto de entalpia y su relacion con las reacciones endotermicas y exotermicas. Saludos desde Argentina!
german, 10 Años Antes
Enserio gracias, mañana tengo examen D: ,deberían contratar a la señorita profesora en mi escuela se le entiende (: , no como a mi profesor e.e Saludos desde Perú <3 c:
Lorena Montenegro, 10 Años Antes
Hola Lorena, me alegra que te haya servido, ¡mucha suerte con tu examen!
QuimiTube, 10 Años Antes
Exelente, me gusta la quimica
omarcruz, 10 Años Antes
Me alegra que te guste, es una ciencia apasionante. Un saludo.
QuimiTube, 10 Años Antes
gracias!!!! me ayudo demasiado creo que le entendí mejor a usted que al maestro!!! saludos desde México
emmanuel, 10 Años Antes
Hola Emmanuel, muchas gracias por tu comentario, me alegra mucho que te haya servido, un saludo grande.
QuimiTube, 10 Años Antes
Hola.. no tendras un video donde se explique a que se refiere cuando un proceso es termodinamicamente estable, inestable y metalestable???
Karina, 10 Años Antes
¡Hola! No, lo siento, eso es de nivel universitario y de momento no hemos llegado a ello… Un saludo grande.
QuimiTube, 10 Años Antes
Hola gracias por tu gran informacion no como mi profesor magaña pero alguien me puede explicar la tabla de formacion de compuestos saludos desde mexico 🙂
Natalia, 10 Años Antes
Hola Natalia, ¿te refieres a la tabla con los valores de entalpías? Esta está en pdf
http://www.quimitube.com/wp-content/uploads/2013/04/Tabla-entalpias-estandar-formacion-compuestos-organicos-e-inorganicos.pdf
También podría servirte este ejercicio resuelto para acabar de entender mejor:
http://www.quimitube.com/videos/termodinamica-ejercicio-13-calcular-la-entalpia-de-descomposicion-del-carbonato-calcico-con-las-entalpias-de-formacion
Un saludo y ánimo
QuimiTube, 10 Años Antes
me estas salvando el curso ,muchisimas gracias !!!!!
maria, 10 Años Antes
Muchas gracias a ti por comentar 🙂
QuimiTube, 10 Años Antes
Hola! Tengo una duda el H2 tiene entalpia de formacion 0 no? Entonces el H tiene una entalpia de formacion distinta de 0??!?
Raquel, 10 Años Antes
Hola Raquel, efectivamente si consideras la reacción H2(g) –> 2H (g) la entalpía es distinta de 0. Ahora bien, no creo que encuentres en ningún problema que tengas H, porque su estado normal es H2 gaseoso.
QuimiTube, 10 Años Antes
me salvaste el semestre gracias
J. JESUS ARAIZA ARVILLA, 10 Años Antes
Me alegra mucho, un saludo grande.
QuimiTube, 10 Años Antes
¡Hola ! Muchas gracias por las clases me han servido mucho. Lo que pasa es que quisiera saber como obtener las entalpias de formación del glicerol, acroleina, 1,2-dihidroxipropeno y 1,3-dihidroxipropeno que son compuestos que no en podido encontrar en tablas.
Andres, 10 Años Antes
Hola Andrés, se me ocurre que podrías obtener los valores de forma aproximada (no es tan preciso como con entalpías de formación de los compuestos que intervienen) con energías de enlace, como explicamos en este vídeo:
http://www.quimitube.com/videos/termodinamica-calculo-de-la-entalpia-de-reaccion-a-partir-de-las-entalpias-de-enlace
QuimiTube, 10 Años Antes
Hola estoy muy agradecida por la explicación en los diferentes vídeos termodinámicos; solo quisiera saber como aprender a calcular las entalpias de formación de diferentes compuestos; ya que si no tenemos la tabla a la mano seria muy practico saber hacerlo gracias. Agradezco hicieras un vídeo sobre tema.
Hellen Caballero, 10 Años Antes
Hola Hellen, lo lamento, si no tienes tablas no puedes calcular las entalpías de formación así como así, esos valores se obtienen en laboratorio o aplicando cálculos teóricos complejos, pero no hay una fórmula general.
QuimiTube, 10 Años Antes
Gracias por todo lo que explica, es de mucho servicio para orientar el estudio. Ademas usted es una mujer muy hermosa. Gracias.
Wilson Alberto Suárez Prada, 9 Años Antes
Muchas gracias Wilson y bienvenido. Un saludo.
QuimiTube, 9 Años Antes
Hola sabes no me queda muy claro la diferencia entre entalpia de formacion y de reaccion pordrias explicarme porfis
vanessa, 9 Años Antes
Será entalpía de formación si la reacción es en concreto la formación de un compuesto a partir de sus elementos, por ejemplo:
C + O2 = CO2
Pero si es una reacción cualquiera que no sea la formación de un compuesto a partir de sus elementos, le llamamos simplemente entalpía de reacción, como un término genérico.
QuimiTube, 9 Años Antes
cual es la entalpia de formacion del hidruro de sodio?
Nallely Zavaleta, 9 Años Antes
Muy elegante y detallado felicidades por la pagina, por cierto tendran libros para descargar.
Saludos desde Bolivia.
Saúl Mamani, 9 Años Antes
Porqué el carbono del grafito es 0 y el del diamante 1.9 ??
Felicitaciones por la web!
Andres Martinez Arribas, 9 Años Antes
Al tener estructuras distintas su estabilidad termodinámica es distinta aunque muy similar, de ahí que tengan distintos valores. Esto ocurre siempre con las distintas formas alotrópicas de un mismo elemento. Un saludo y gracias.
QuimiTube, 8 Años Antes
sos una geniaaaaaaaaa
Majo Balquinta, 9 Años Antes
¡Gracias!
QuimiTube, 9 Años Antes
Gracias!! muy lindo y útil tu trabajo
bachi, 8 Años Antes
Muchas gracias a ti por comentar, un saludo.
QuimiTube, 8 Años Antes