Contenido del Vídeo
En este apartado comenzamos el tema de Termoquímica o Termodinámica Química, términos con los que en este curso haremos referencia indistinta al estudio de las transferencias energéticas aplicado a las reacciones químicas.
En todo proceso, tanto físico como químico, están implicadas ciertas energías de distintos tipos (energía potencial, energía cinética, energía eléctrica…). La ciencia que estudia los cambios energéticos en sus distintas manifestaciones, en cualquier tipo de proceso, recibe el nombre de termodinámica. Si dicha ciencia se aplica al estudio de los cambios químicos, entonces, como hemos comentado previamente, la llamaremos termoquímica o termodinámica química. Aunque en ocasiones no se consideran términos equivalentes, en este curso no haremos distinción entre ellos.
Leyes fundamentales de las reacciones químicas: conservación de la masa y de la energía
Este estudio energético de los cambios químicos es fundamental para tener una visión completa de las reacciones químicas, ya que estas obedecen a dos leyes fundamentales:
- La Ley de Conservación de la Masa (Ley de Lavoisier). Durante una reacción química no se crea ni se destruye materia, la masa de reactivos inicial es igual a la masa final de productos.
- La Ley de Conservación de la Energía, que constituye el Primer Principio de la Termodinámica en su formulación más simple, que es que «la energía ni se crea ni se destruye, sólo se transforma». En un apartado posterior tratamos en profundidad este Primer Principio.
La segunda ley, relativa a la energía, es también importante dado que todo proceso químico lleva siempre asociadas variaciones energéticas entre reactivos y productos. La energía de estos cambios puede ser de distintos tipos: energía luminosa, energía eléctrica, trabajo mecánico… aunque lo más habitual es que se manifieste como un flujo de calor entre el sistema reaccionante y el entorno.
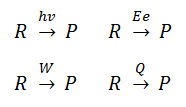
Definición de sistema termodinámico y de entorno
Vemos que han surgido dos conceptos, el de sistema y entorno, que surgen de la necesidad de delimitar el objeto de estudio para poder estudiar los cambios de energía asociados a una reacción química. El SISTEMA es la parte del Universo que se aísla del resto para observarlo, en nuestro caso, por ejemplo, un recipiente en el que tiene lugar una reacción química, o un proceso físico relacionado con una sustancia, como una disolución, una fusión, una vaporización…; el ENTORNO es todo lo que rodea al sistema, pudiendo estar relacionado con el mismo o no estarlo.
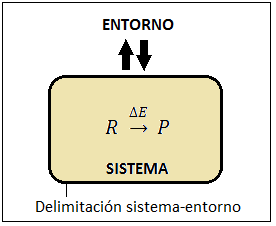
La separación entre el sistema y el entorno puede ser real o imaginaria. Por ejemplo, puede ser física, como las paredes de un tubo de ensayo, de un erlenmeyer o de un vaso de precipitados, o una delimitación imaginaria establecida de un modo arbitrario, como una zona de la atmósfera en torno a una hoguera con la cual deseamos estudiar una reacción de combustión:

Tipos de sistemas termodinámicos
Los sistemas termodinámicos se clasifican en sistemas abiertos, cerrados o aislados según su capacidad para intercambiar materia y energía con el entorno. Así:
- Sistema abierto: puede intercambiar con el entorno tanto materia como energía, generalmente en forma de calor. Por ejemplo, la combustión de madera al aire libre, o una reacción química en un vaso de laboratorio abierto, que permite tanto el paso de calor a través de las paredes del recipiente (se dice que el recipiente tiene paredes diatérmicas) como desprendimiento de gases.
- Sistema cerrado: puede intercambiar energía con el entorno, pero no materia. Por ejemplo, un recipiente cerrado de vidrio en el que se lleva a cabo una reacción química que desprende calor. Los gases formados no pueden abandonar dicho recipiente porque está cerrado con un tapón, pero el calor sí que puede desprenderse porque las paredes de vidrio son diatérmicas. Si tocamos el recipiente con las manos, lo notaremos caliente.
- Sistema asilado: no es posible el intercambio ni de materia ni de energía. Por ejemplo, lo que se conoce coloquialmente como un termo, que técnicamente es un vaso Dewar y que se usa para llevar infusiones o café y que se mantengan calientes más tiempo, es en teoría un sistema aislado, que no permite ni el paso de materia ni de energía. No obstante, los sistemas aislados son teóricos, en la práctica siempre hay cierto intercambio leve de energía y al final, el café se acaba enfriando (¡mala suerte!).
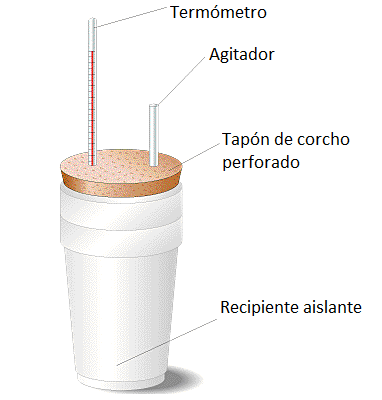
Calorímetro de laboratorio: ejemplo de sistema aislado
Asimismo, los sistemas reaccionantes también se pueden clasificar en función del estado de agregación de reactivos y productos. Si todos los componentes se halla en el mismo estado de agregación (sólido, líquido o gas), es decir, tenemos una sola fase, tendremos lo que se denomina un sistema homogéneo. Por ejemplo, la combustión del metano es un sistema homogéneo, ya que todos los componentes son gases:
![]()
Si tenemos componentes con distintos estados de agregación, es decir, tenemos varias fases, entonces se trata de un sistema heterogéneo. Por ejemplo, la descomposición de carbonato de magnesio sólido por calcinación con desprendimiento de dióxido de carbono:
![]()
Especificados ya los tipos de sistemas termodinámicos que existen, en el Apartado 2 de teoría de Termoquímica nos centraremos en el estudio de las llamadas variables termodinámicas.
Category: Teoría de Termoquímica y Termodinámica Química.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
genial la verdad acabo de terminar los examenes y tenia pendiente repasar termoquimica muchas gracias por compartir conocimientos …….nos estas ayudando mucho!!
david, 12 Años Antes
¡Hola David, bienvenido! Gracias a ti por comentar, espero que todo lo de termoquímica llegue a tiempo para que puedas repasarlo. Un saludo grande 🙂
QuimiTube, 12 Años Antes
Los felicito, es una página amena, didáctica e interesante.
Pascualina Chirico, 11 Años Antes
¡Muchas gracias! 😀
QuimiTube, 11 Años Antes
Maravillo tu sitio !!!
Llevo hora viendo tus videos…termodinamica es mi pasión amateur
Gracias.
Luis Alberto, 11 Años Antes
A mí me maravilla que tu pasión sea la termodinámica, es bonito 🙂 Un saludo muy grande
QuimiTube, 11 Años Antes
Hola, muy buena la pagina, queria saber si se pueden hacer preguntas concretas, yo lo que necesito saber es los tipos de reacciones, y nose como buscarlo en internet en un libro, por ejemplo una reaccion de condensacion. Queria saber si me pueden pasar los tipos de reacciones y si son exotermicas o endotermicas! Muchas gracias
gabi, 11 Años Antes
¡Hola Gabi! Pregunta concretas sí, aunque la tuya no es muy concreta, es más bien muy general… Y no tenemos aún apuntes descargables ni vídeos sobre química orgánica, lo lamento.
QuimiTube, 11 Años Antes
Hola! en los tipos de sistemas dice:
Sistema abierto
sistema cerrado
y sistema asilado!
puede este último ser «aislado»?
Excelente el sitio! me está ayudando un montón!
Aldo, 11 Años Antes
¡Hola Aldo! Efectivamente es aislado, creo que lo pone así en la pizarra pero igual no se acaba de ver del todo bien. Un saludo.
QuimiTube, 11 Años Antes
Buenos días,
Me llamo Loli, y estudio 2º de bachillerato. He visto la página y creo que me puede ayudar. Tengo problemas de audición y cuando asisto a clases de química me pierdo, una porque el profesor va muy rápido y no lo puedo seguir. Quiero aprender y hacer las cosas bien, enterarme bien de que va el tema, espero que Quimitube, me ayude.
Gracias.
Loli
Dolores Rivero, 11 Años Antes
¡Hola Loli! Espero que te pueda ayudar muchísimo. Es una pena que los subtítulos de YouTube no vayan del todo bien, creo que te podrían servir de mucho, a ver si en el futuro podemos subtitular los vídeos correctamente. Si tienes cualquier duda o consulta puedes formularla, es muy importante eso que dices de hacer bien las cosas y enterarte bien del tema, es la base del aprendizaje. Un abrazo y ánimo con 2º, es bastante duro.
QuimiTube, 11 Años Antes
Muchísimas gracias por compartir estos vídeos.
¡Me habéis salvado la vida con mi examen de termoquímica!
Ahora me pondré a ver los de ácido – base y redox.
Seguid así de bien, me encantan esta página y el blog.
F, 11 Años Antes
¡Hola! Me alegra que te sirva 🙂 Ácido-base no se ve tan bien porque la cámara era más antigua, pero igualmente los contenidos y el orden te pueden servir muy bien. Un saludo grande y ánimo con tus estudios.
QuimiTube, 11 Años Antes
Hola soy del IES Murillo de Sevilla y nuestro profesor de Química solo pone tus vídeos en clase, así que gracias por ser mi profesora.
Josema, 11 Años Antes
De nada 😀
QuimiTube, 11 Años Antes
buena pagina me gusta sigan asi 🙂
oscar, 11 Años Antes
Estoy haciendo un trabajo de Termodinámica química y los vídeos mas la información son de mucha ayuda. Gracias, saludos desde Argentina 😀
Melqui, 10 Años Antes
Me alegra mucho que te sirvan, mil gracias por tu comentario y suerte con tu trabajo. Un saludo.
QuimiTube, 10 Años Antes
Esta pagina realmente me ayuda, repetirme las clases una y otra vez al final se acaba quedando
Un fallo:
«Sistema asilado: no es posible el intercambio ni de materia ni de energía….»
Sistema aislado?
Dongxu, 10 Años Antes
¡Sí, disculpa, aislado! Muchas gracias por el comentario, me alegra que te sirva.
QuimiTube, 10 Años Antes
Hola Dra.
Disculpa no se tu nombre. Me parece excelente tu portal porque tienes una excelente didáctica. Referente a las autoevaluciones como se que estoy bien si lo he hecho correctamente. Tienes algun solucionario o no esta dentro de tu portal colocar esto. Gracias y sigue adelante excelente.
Cordial saludo,
Frank Camino
Frank Camino, 10 Años Antes
¡Hola! Me llamo Carmen. Muchísimas gracias por tu comentario, me anima mucho. En cuanto a las autoevaluaciones la idea es añadir de todos los temas y de todos los vídeos con sus solucionarios correspondientes, pero llegará más adelante porque ahora me resulta imposible. Un saludo grande.
QuimiTube, 10 Años Antes
Ésta página es maravillosa….ojalá hubiera existido cuando yo estudiaba, hoy me apoyo en ella para dar clases particulares. Gracias por compartir la información. Sandra.
Sandra, 10 Años Antes
¡Muchas gracias Sandra! Me animan mucho a continuar los comentarios como el tuyo. Un abrazo.
QuimiTube, 10 Años Antes
Millones de gracias por esta maravillosa labor!!!! Esta página me está ayudando muchísimo con mis estudios… Tengo 33 años y estoy comenzando una carrera de Ciencias de la Alimentación y consigo mucho apoyo en estos vídeos, ya que no cuento con buenas bases 🙁 Así que infinitas graciaaaaaaaaaaaaaasssssss :*
Johanna De La Corte, 10 Años Antes
¡Hola Johanna! Muchísimas gracias a ti por dejar este comentario que me anima tanto a continuar, crear contenido para personas que lo agradecen y que realmente encuentran una ayuda en ello es un lujo. Un abrazo grande y mucha suerte con tus estudios!
QuimiTube, 10 Años Antes
Hola, estoy estudiando 2°de bachillerato y me cuesta bastante la química y encima la profesora va muy rápido, espero que estos vídeos me sirvan de ayuda para poder aprobar y con buena nota . También quería preguntarte si hay algún vídeo de formulación para poder así repasarla?
Mariam, 10 Años Antes
¡Hola Mariam! Mucho ánimo, la química en segundo se hace un poco dura pero espero que quimitube te sirva, si tienes dudas pregúntame. Aún no tenemos los vídeos de formulación aunque sí que hemos grabado unos para otra plataforma que saldrán en breve, aunque aún no puedo indicar el nombre. Espero que lleguen pronto. Un saludo grande.
QuimiTube, 10 Años Antes
buenaaas, muchas gracias por todos los videos, me estas salvando el curso!!! 🙂 eres la mejor
arnau, 10 Años Antes
¡Hola! Muchas gracias Arnau, me alegra mucho que te sirvan tanto y que dejes un comentario 😀 Un abrazo
QuimiTube, 10 Años Antes
Muy bien la explicación
Nilo Ortega, 9 Años Antes
¡Muchas gracias!
QuimiTube, 9 Años Antes
Muy bueno, la verdad yo enseño el curso de química y sus vídeos son como un guía que me ayuda a perfeccionar mis métodos de enseñanza y ampliar mis conocimientos. Y bien dicen que uno nunca termina de aprender.
Edwin, 9 Años Antes
¡Muchísimas gracias Edwin! Es un honor viniendo de un colega. Un saludo grande.
QuimiTube, 9 Años Antes
Muchas gracias, explica muy bien :).
Jose, 8 Años Antes
Muchas gracias a ti por comentar, un saludo grande.
QuimiTube, 8 Años Antes
Excelente, profe me ayudó muchísimo mientras estuvo cursando la materia de Química II en mi universidad, continúen así, los felicito !
Francisco, 8 Años Antes
Muchas gracias por tu comentario, un abrazo!
QuimiTube, 8 Años Antes
Me gustaría que me orientases en la siguiente duda.
He estado leyendo sobre el principio del universo y sabemos que tenía unos 100. 000. 000. 000 K de temperatura.
Y leo: La expansión del universo producía una disminución de la densidad de energía que tenía que distribuirse en un volumen cada vez mayor. Este proceso implicaba a su vez una disminución de la temperatura del universo, proceso que continúa ocurriendo hoy en día.
Y mi pregunta es: ¿cuál es el proceso por el que al disminuir la densidad diminuye la temperatura?
Si el universo, al principio, estaba en equilibrio térmico y la disminución de la temperatura representa la disminución de la vibración de las partículas y pérdida de energía de estas ¿dónde va a parar toda la energía? ¿si todas las partículas tienen la misma temperatura qué absorbe la vibración perdida?
También he leído que con los choques los protones se convertían en neutrones y viceversa, pero como los neutrones son más pesados, se necesita más energía para cambien de un protón a un neutrón que viceversa. ¿se pierde temperatura en este proceso?
Hoy en día el universo se sigue expandiendo y se sigue enfriando ¿cómo?
Por ejemplo: unas partículas aisladas en el universo si no chocan con otra que tenga menos temperatura, ¿puede enfriarse? Porque emiten radicación ¿no?.
Bueno, no te molesto más.
Muchas gracias por todo.
Tomás Pérez, 8 Años Antes
es posible entregarle calor a un gas y que su temperatura disminuya?
Rosanna, 4 Años Antes
Hola! Te sugiero echar un vistazo a estos apuntes que profundizan más en la materia: http://www.sc.ehu.es/sbweb/fisica_/estadistica/termodinamica/termo1/termo1.html
QuimiTube, 4 Años Antes