Contenido del Vídeo
En este ejercicio resuelto del tema de termoquímica calcularemos la variación de entropía de algunas reacciones. El enunciado completo es el siguiente:
Calcular la variación de entropía de las siguientes reacciones a partir de las entropías molares estándar de los compuestos de las sustancias que intervienen en las mismas.
- Descomposición térmica del carbonato cálcico
- Creación de dióxido de nitrógeno a partir de monóxido de nitrógeno y oxígeno
- Cloruro de bromo a partir de bromo y cloro
Disponemos de los datos en la siguiente tabla, donde nos indican las entropías molares estándar de las sustancias que intervienen en los 3 apartados. Vamos a realizar el cálculo utilizando la fórmula explicada en el vídeo de teoría Termodinámica Teoría 19.1: Cómo calcular la variación de entropía de una reacción con las entropías molares estándar.
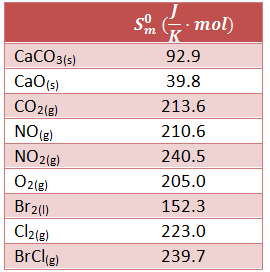
En este caso, la fórmula a utilizar será la siguiente:
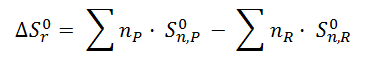
Como se puede observar es una fórmula muy parecida, ya utilizada en apartados anteriores, a la fórmula del cálculo de la variación de entalpía de una reacción a partir de las entalpías de formación. Las principales diferencias entre la fórmula de entropía y entalpía es que para la entropía no existe el símbolo griego delta, Δ, ya que en la tabla aparecen valores absolutos de entropía y no variaciones. Además, para el caso de las entropías molares estándar las entropías de los elementos no son cero.
Veamos la resolución escrita del ejercicio que se resuelve y explica paso a paso en el vídeo:
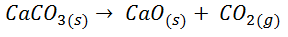
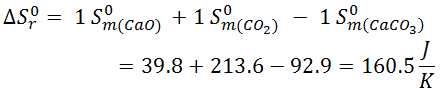
Como ΔS > 0, significa que aumenta el desorden, lo cual es normal, ya que pasamos de tener un sólido, altamente ordenado, a tener un sólido y un gas, este último completamente desordenado.
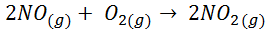
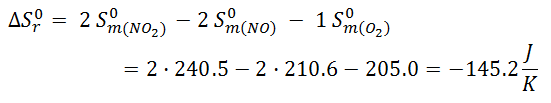
En este caso ΔS < 0, lo cual quiere decir que ha disminuido el desorden. Es lógico, ya que inicialmente había 3 moles de reactivos y, cuando la reacción se lleva a cabo, sólo hay 2 moles de productos. Como el número de moles de gas ha disminuido el desorden también disminuye.
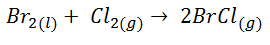
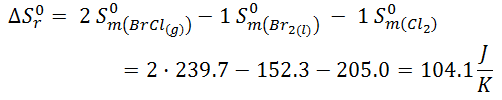
En este caso la variación de entropía aumenta, ya que tenemos dos moles de producto en forma gaseosa, mientras que tenemos un mol en forma líquida y un mol en forma de gas en los reactivos. Por lo tanto, como hay un mayor número de moles en forma de gas en el producto, es lógico que le desorden haya aumentado y que ΔS < 0.
También te puede interesar:
Ejercicio 31 termoquímica: determinar qué sustancia tiene mayor entropía molar estándar
Todos los vídeos de teoría de termoquímica
Todos los vídeos de ejercicios de termoquímica
Category: Ejercicios de Termoquímica y Termodinámica Química.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Disculpen la molestia tienen los valores de entropia de la glucosa y el valor de su entalpia de dicho compuesto es – 1274.4
Humberto Martínez, 11 Años Antes
Lo siento Humberto, no dispongo del valor.
QuimiTube, 11 Años Antes
la actividad b) me da -146´2… hice algo mal??
Gwen, 11 Años Antes
¡Hola! No lo sé, quizás algún signo? Un saludo.
QuimiTube, 11 Años Antes
Hola, en la 2º ecuación, por que restas la entropía del oxígeno?
La formula es suma de las entropías de los productos menos suma de las entropías de los reactivos?
Gemi, 9 Años Antes
¡Hola! Sí, aquí tienes la explicación teórica de la fórmula y también por escrito a pie de vídeo está todo:
http://www.quimitube.com/videos/termodinamica-teoria-19-1-como-calcular-la-variacion-de-entropia-de-una-reaccion-con-las-entropias-molares-estandar
Un saludo.
QuimiTube, 9 Años Antes
Entendido. Muchas gracias!!!!
Gemi, 9 Años Antes