Contenido del Vídeo
En este ejercicio calcularemos la entalpía de una reacción química a partir de las entalpías de formación de los compuestos que intervienen en la reacción. En concreto, se trata de la reacción entre el cloruro de hidrógeno y el oxígeno para dar cloro gaseoso y agua. El enunciado completo dice lo siguiente:
Calcular la variación de entalpía de la siguiente reacción:
A partir de las entalpías de estas otras reacciones:
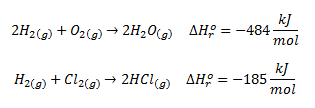
Para el cálculo utilizaremos la fórmula vista en teoría,

También te puede interesar:
Calcular la entalpía de descomposición del carbonato cálcico con las entalpías de formación
Calcular la entalpía estándar de formación del cloruro potásico por estequiometría
Y también:
Todos los vídeos de teoría de termoquímica
Todos los vídeos de ejercicios de termoquímica
Category: Ejercicios de Termoquímica y Termodinámica Química.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Hola, igual me equivoco pero, los 57 KJ no es el calor que se desprendería en la combustion de 2 moles de HCl? para 1 mol de HCl no serian 28,5, la mitad?
Aunque al aplicar la formula las unidades estan en KJ/mol, asi que el resultado serian KJ/mol.
Por favor, aclarame esta contradiccion.
Muchas gracias.
Deb, 11 Años Antes
Hola! si nos dan los datos en KJ/mol entonces no tendriamos que dividir por dos??
Sachet, 11 Años Antes
hola, mira el enunciado que escribes en la pizarra y el que escribes abajo no es igual y puede dar a confusion
sara, 11 Años Antes
a condicion normal h2o no debe ser liquido?
juan, 10 Años Antes
¡Hola Juan! Sí, tienes razón, aunque a veces se pone así como aproximación porque se tienen esas entalpías concretas, así que nos ceñimos a las reacciones tal y como nos las dan en el enunciado. Un saludo.
QuimiTube, 10 Años Antes
Muy útil para quien estudio Quimifica hace 50 años
gracias
Eduardo Delpiano, 9 Años Antes
Hola Eduardo, espero que te haya servido en efecto para recordar. Un saludo grande.
QuimiTube, 9 Años Antes