Contenido del Vídeo
Explicaremos la teoría en la que se basan los indicadores ácido base, es decir, un equilibrio ácido base en el que la forma molecular (HIn) y la forma desprotonada (In–), presentan distinto color, por lo que el color que tome la disolución al añadir unas gotitas de indicador ácido base dependerá del pH de la misma. Asimismo también deduciremos una ecuación (análoga a la ecuación de Henderson-Hasselbach para soluciones amortiguadoras) que nos permitirá el cálculo de su intervalo de viraje.
El equilibrio ácido base que se produce es el siguiente:
HIn(aq) + H2O(l) ⇔ In–(aq) + H3O+(aq)
Color A Color B
Finalmente veremos el ejemplo de tres indicadores de uso común: el naranja de metilo (viraje ácido), el azul de bromotimol (viraje neutro) y la fenolftaleína (viraje básico). Para un ejemplo concreto de cálculo del intervalo de viraje de un indicador ácido base puedes ver el Ejercicio 21: Cálculo del intervalo de viraje de un indicador.
En la siguiente tabla puedes consultar los intervalos de viraje de una serie de indicadores de uso común en el laboratorio:
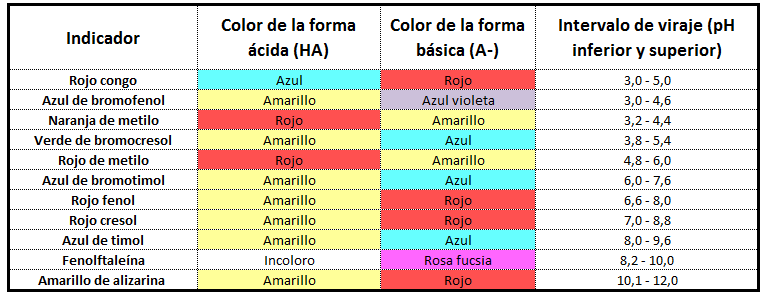
El valor del intervalo de viraje nos permite elegir el indicador adecuado para la realización de una valoración ácido-base en función de a qué valor de pH se produzca el salto (punto de equivalencia) de la titulación.
Category: Teoría ácido base y Vídeos Ácido base.
Etiquetas: Indicadores ácido-base.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
porque se le llama HIn y In?? de donde vienen? Muchas gracias!
Dayana, 12 Años Antes
¡Hola Dayana! Pues se llama In por indicador, forma protonada del indicador, HIn, y forma desprotonada del indicador, In. De todas formas no es necesario llamarlo así, se puede llamar de cualquier otra forma, por ejemplo HA y A o lo que tú prefieras, esta es sólo una nomenclatura más. Un saludo grande.
QuimiTube, 12 Años Antes
No entiendo bien como sale la ecuación, ¿Por qué se coloca H3O+ y no simplemente H+?
En que consiste el efecto del Ion común?
andrea, 11 Años Antes
¡Hola Andrea! Puedes poner tanto H+ como H3O+. Se suele poner más bien este último porque en realidad los protones, H+, cuando están en agua se combinan con una molécula de agua para dar H3O+, y por este motivo es más habitual ponerlo de este modo. En cuanto al efecto del ión común es un efecto relacionado con el equilibrio químico, pero no tan relacionado con los indicadores ácido base.
QuimiTube, 11 Años Antes
cual es el color que toma para saber si es acido o base
carmin, 11 Años Antes
¡Hola! En la tabla que tienes en la explicación escrita verás los colores que toma cada indicador según el medio sea básico o ácido. Por ejemplo, el rojo de fenol que tiene un intervalo de viraje de 6,6 a 8,0, cambia de amarillo a rojo. Esto significa que es amarillo por debajo de 6,6 (ácido) y rojo por encima de 8,0 (básico). Así con el resto puedes ir interpretando la tabla.
QuimiTube, 11 Años Antes
Hola, que tal una pregunta como hago para saber que indicador utilizar en una titulacion de azul de metileno, con ácido clorhídrico, ya valorado; tengo un Hcl de 0.05 M ya valorado, y tengo mi analito de azul de metileno también a 0.05M, pero quiero encontrar su concentración exacta por estandarizacion , gracias por su respuesta..
irving, 10 Años Antes
Hola Irving, para determinar el pH necesitas saber el intervalo de viraje de tu analito, lo cual puedes determinar con su pKa. Normalmente un indicador que vire en torno a este valor te irá bien.
QuimiTube, 10 Años Antes
[…] http://www.quimitube.com/videos/teoria-8-indicadores-acido-base […]
Skype – Blog de Nerea, 5 Años Antes