Contenido del Vídeo
Veremos la explicación teórica del mecanismo de acción de una disolución reguladora (ejemplo del ácido acético/acetato, CH3COOH/CH3COO–).
Una disolución reguladora la forman una mezcla de ácido débil y su base conjugada (como en el ejemplo) en concentraciones relativamente elevadas, aunque también puede estar formada por una mezcla de una base y su ácido conjugado (amoníaco/amonio).
También deduciremos la ecuación de Henderson-Hasselbach, que resulta de despejar la concentración de iones hidronio, [H3O+], de la constante de acidez, Ka, y aplicar después logaritmos negativos, y veremos cómo aplicar dicha ecuación para el cálculo del pH al que amortigua una disolución reguladora en función de las concentraciones de ácido y base conjugada (sal) adicionadas.
La ecuación de Henderson-Hassselbach así deducida, que de la siguiente forma:
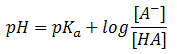
Hay que tener en cuenta que la capacidad reguladora de la disolución tampón es máxima cuando las concentraciones de ácido y de sal son iguales. En el caso del ejemplo, cuando tenemos una concentración de ácido acético igual a la de acetato sódico, tendremos una capacidad reguladora máxima y un pH = pKa del ácido acético.
Category: Teoría ácido base y Vídeos Ácido base.
Etiquetas: Soluciones amortiguadoras o reguladoras.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
He entendido todo menos lo de pKa.¿cómo se halla pKa?¿es un valor que se nos tendría que dar en los ejercicios? =.=
Leial, 13 Años Antes
Pka= -log Ka
Alejandra, 12 Años Antes
Hola Alejandra, bienvenida 🙂
Sí, en efecto, el pKa = -log Ka igual que ocurre con el pH o el pOH.
Un saludo
QuimiTube, 12 Años Antes
¡Hola! El concepto es el mismo que en el caso del pH o del pOH es decir, el prefijo p implica que aplicamos -log a lo que se nos diga. Por tanto, el pKa es simplemente hacer el -logKa, es decir, logaritmo negativo de la constante de acidez. Del mismo modo, para bases, el pKb es el -logKb. ¿Que por qué se hace esto disponiendo de Ka y Kb, si el pKa y el pKb no aportan más información? Se hace porque así los valores son más manejables, por nada más. Por ejemplo, el acético tiene una Ka de 1,8·10^(-5) y un pKa de 4,7, mucho menos engorroso. De todos modos en los ejercicios te suelen dar la constante y no el pK.
Quimitube, 13 Años Antes
Muchísimas gracias 🙂 los vídeos me están ayudando muchísimo ^^
Leial, 13 Años Antes
Me alegra muchísimo leer eso 🙂 Me anima a seguir grabando, ¡gracias!
Quimitube, 13 Años Antes
Hola Profe. Felicitaciones por el sitio tan interesante.
Profe tengo una consulta.
Como calcular el volumen de acido acetico 1N que se requiere para que al agregar 680 g de acetato de sodio en 5 litros de solución, esta genere un pH de 6.1??????
De nuevo muchas gracias
Mauricio, 12 Años Antes
Hola Mauricio, bienvenido. Te sugiero que veas el vídeo sobre disoluciones amortiguadoras o reguladoras, que es lo que tendrás cuando mezcles ácido acético con acetato sódico: http://www.quimitube.com/videos/ejercicio-20-calculo-del-ph-de-una-solucion-amortiguadora-por-henderson-hasselbach/
No obstante el ejercicio que tú planteas es más complejo que el ejercicio 20. Te lo comento orientándote un poco y si no te sale me lo comentas y profundizamos un poco más. Primero calcularás la molaridad de acetato sódico, sabiendo que un mol de ácido acético son 82 gramos. Así, como tienes 680 gramos de acetato sódico en 5 litros, te da una molaridad de 1,66. Por otra parte el pH que quieres conseguir es 6,1 y el pKa del acético es 4,75. Estos tres datos, el 1,66, 6,1 y 4,75 son los datos que necesitas para sustituir en la ecuación de Henderson-Hasselbach. La única incógnita que te quedará es la concentración de ácido acético, que te da un valor de 0,074M. Es decir, tú necesitas que la concentración final de ácido acético en tu recipiente de 5 litros sea de 0,074 moles/litro, y debes calcular a partir de eso el volumen de ácido acético 1N que necesitas para tener dicha cantidad de moles.
Un saludo y gracias por comentar
Quimitube, 12 Años Antes
Muchas gracias profe.
Entonces lo que faltaría es utilizar esta fórmula y despejar v1:
Como 1N igual a 1M en este caso.
c1v1 =c2v2
1M*v1=0.074*5000ml
v1=370 ml
Es esto cierto?????
Gracias por su ayuda profe. Un abrazo!!!!
Mauricio, 12 Años Antes
A mí me da el mismo valor, 370 ml, aunque será despreciando dicho volumen, teniendo en cuenta que tenemos 5000 ml y no 5370 ml. Un saludo.
Quimitube, 12 Años Antes
Profe.
Lo que yo entiendo es que contar los 370 ml de acido acético 1N=1M dentro de los 5 L de Soluciónn que tiene 680 g de acetato de sodio.
Es cierto?????
Gracias..
Mauricio, 12 Años Antes
Muchas gracias por los videos, me han sido de mucha utilidad.
No entiendo por que se refieren al Acetato Sodico CH3COONa como la base conjugada, siendo la base conjugada unicamente CH3COO.
Por que se refieren a la sal como una base conjugada?
Espero hacerme entender.
goGo, 12 Años Antes
¡Hola! Bueno, tienes razón, es el anión acetato, CH3COO-, el que se comporta como base, siendo capaz de captar un protón nuevamente para volver a formar la especie molecular del ácido acético, CH3COOH. No obstante, ese anión que tú introduces en la disolución para formar una disolución reguladora tiene que tener un contraión, en este caso, el anión acetato va acompañado de catión sodio, y por ello decimos, quizá de forma inexacta, que la base conjugada es el acetato sódico, aunque el sodio no intervenga en absoluto en la reacción ácido base. Gracias por el aporte y bienvenido.
QuimiTube, 12 Años Antes
Comprendido.
De verdad muchisimas gracias, estaba muy estresado ya que no entendia muy bien estos temas con las clases de la U
Ahora todo me queda muy claro. Excelente trabajo!
goGo, 12 Años Antes
¡De nada! Y gracias a ti, me alegra mucho que digas eso y espero que te sean de mucha ayuda. Si te queda cualquier duda puedes preguntarme siempre que quieras.
Un saludo,
Carmen
QuimiTube, 12 Años Antes
Hola :), al ver el vídeo me ha surgido una duda. Al deducir la ecuación de Henderson-Hasselbach partidmos de la expresión de Ka , en la que aparecen las concentraciones de las especies en el equilibrio. No obstante, para sustituir en la ecuación de Henderson utilizamos las concentraciones iniciales. Dado que la ecuación se ha deducido a partir de las concentraciones en el equilibrio, no veo por qué se pude hacer esta sustitución, gracias 🙂
óscar, 12 Años Antes
Hola Óscar, bienvenido, y disculpa la tardanza en responder, ando con poquito tiempo. En realidad tal vez sería más adecuado deducir la expresión a partir del cociente de reacción, Qr, que es lo mismo que la constante de equilibrio pero con las concentraciones de que se disponga, aunque no sean en equilibrio.
QuimiTube, 12 Años Antes
Primero de todo agradecerte los videos, saqué ya un excelente en el pasada examen gracias a tu web!
Respecto a mi duda, como consecuencia de tu última respuesta ala pregunta de Óscar, no entiendo porque ponemos lo de x -1 , si después en la formula utilizas el 1 inicial, es decir, de que sirve la esa tabla?? GRACIAS!
marc, 12 Años Antes
Buenos dias,
me gustaria agradecerle por su web que tantas dudas nos resuelve. Ademas de que usted sea una profesora muy guapa y sonriente realmente explica de maravilla.
Muchas gracias y espero que continue asi.
simon, 11 Años Antes
¡Gracias Simón y bienvenido! Me alegro de que te guste la web, un saludo enorme.
QuimiTube, 11 Años Antes
Me Pareció muy bueno tu video.
Solo tengo una pregunta
¿Hasta cuando deja de suceder éste efecto buffer? y
Cómo podría calcular la pequeña variación de ph que va a producir
por ejemplo 0.2mL de HCl 0.1M en una disolución buffer con 1mL de acético 0.1M y 1mL de acetato de sodio 0.1M (voluem total 2mL).
si es que la produce
Ojalá pueda(n) contestarme.
Sam, 11 Años Antes
¡Hola Sam! La capacidad buffer dependerá de las concentraciones, ahora mismo no te sé decir exactamente qué concentraciones de ácido o de base harán que el efecto buffer se pierda ya que suelo calcularlo en cada caso aplicando la ecuación de Henderson-Hasselbach.
En cuanto a tu duda, lo que debes hacer es plantear el equilibrio correspondiente a la solución amortiguadora de acético y acetato, pero considerando que inicialmente no tienes 0 de H3O+ sino la cantidad procedente del HCl agregado en moles. Con esos datos calculas el valor de H3O+ en el equilibrio (que variará considerablemente con respecto a la solución amortiguadora «normal») y lo usas para determinar el nuevo pH.
QuimiTube, 11 Años Antes
Hola Quimitube, una preguntita rápida
en las disolución en teoría de hidrólisis de los vídeos anteriores a este, era el ion en los reactivos y el compuesto de donde procedía en productos tal como aqui: no ?
( CH3COO- + H2O = CH3COOH + H3O+ )
porque se puede formular al revés? cuando hay que hacerlo? cual es el fin. muchisimas gracias
y siento tener que preguntarlo !!! mucha animo y gracias de nuevo
PedroMagna, 11 Años Antes
A la gente que nos cuesta nos re sirve, mil gracias por tomarte el tiempo! =)))
Car, 11 Años Antes
Gracias a ti por comentar 🙂
QuimiTube, 11 Años Antes
Hola, quería saber si me puedes orientar en la resolución del siguiente ejercicio ya que hace días que intento resolverlo y ya no sé por dónde cogerlo.
Hallar el pH de una disolución que se obtiene al añadir 40g de NaOH a 1 litro de acético 2M, suponiendo que no se produce cambio de volumen. Si a la disolución resultante anterior se le añaden 0,2 moles más de hidróxido, hallar el nuevo pH.
Ka(CH3COOH)= 1,81.10-05
R: 4,74; 4,92
Desde ya muchas gracias!
Natalia, 11 Años Antes
¡Hola Natalia! Debes tener en cuenta que se trata de una neutralización de un ácido débil, el acético, con una base fuerte, el NaOH. Se neutralizarán tantos moles de ácido acético como moles de NaOH agregas (en este caso agregas 1 mol de NaOH ya que su masa molecular es de 40 gramos). De forma que si neutralizas un mol de ácido acético, te queda una nueva concentración de ácido acético tras las dos neutralizacións (porque agregas NaOH dos veces) y para calcular el pH de esa disolución, lo harás igual que aquí:
http://www.quimitube.com/videos/ejercicio-3-calculo-del-ph-de-un-acido-debil-a-partir-del-valor-de-ka/
QuimiTube, 11 Años Antes
Muchísimas gracias!!
Aprecio muchísimo el tiempo que nos dedicas a mi y a todos los que te hacen consultas.
Espero que sigas por mucho tiempo : )
Natalia, 11 Años Antes
No vengo a consultarte sino que a felicitarte por ayudarnos a los que nos cuesta un poco la quimica, supongo que a todos se les es dificil, pero bueno… dejame decirte, que exelente video, me gusta, explicas algo en 9 minutos de una manera tan buena! Felicidades, segui adelante!:D
Jose, 11 Años Antes
¡Hola Jose, bienvenido! Cuánto te agradezco que pases por aquí para dejar un mensaje de apoyo, nos ayuda mucho a seguir con esta labor. Un saludo muy grande y si te quedan dudas aquí estaremos.
QuimiTube, 11 Años Antes
mira es que necesito resolver esta pregunta pero no la entiendo
1. Suponga que el pKa del H2CO3 es 6,1 y el del H2PO4- ES 7,2. ¿La siguiente afirmación será falsa o verdadera: “una solución molar de NaH2PO4 tiene un pH mayor que 7,0”?
como la resuelvo
kris, 11 Años Antes
No imaginas como me a ayudado esta pagina xD muchas gracias.
Jhon Ramirez, 11 Años Antes
Hola muchas gracias por los videos me estan sirviendo! una pregunta si yo tengo que calcular el ph de una solucion y solo me dan los valores molares de dicha solucion y el kb como hago para averiguar el ph?
lucy, 11 Años Antes
Hola Lucy, creo que te refieres a un ejercicio de este estilo:
http://www.quimitube.com/videos/ejercicio-4-calculo-del-ph-de-una-base-debil-a-partir-de-su-valor-de-kb/
QuimiTube, 11 Años Antes
Tengo una duda
Que pasa si tengo una solución neutra 7 y le adiciono mas acido? que pasa?
Y si tengo un amortiguador HCO3- / H2CO3 si agrego mas acido que le pasa a las especie?
Antonio, 11 Años Antes
Hola Antonio:
Si le agregas ácido a una disolución neutra que no sea reguladora, entonces simplemente su pH disminuirá, pasará a ser un pH menor que 7, ácido. En cambio, si es una disolución amortiguadora como la que indicas y le agregas una pequeña cantidad de ácido el pH apenas cambiará, logrará mantenerlo a pesar de la adición de ácido porque esta es la base de una disolución amortiguadora. Sin embargo, si la cantidad de ácido que adiciones a la solución amortiguadora es muy grande puedes sobrepasar su capacidad de amortiguación y entonces el pH bajaría. Un saludo.
QuimiTube, 11 Años Antes
Amoo estos videos, explican bien, de verdad que buena profesora muchas gracias
Alejandro, 10 Años Antes
¡Muchas gracias Alejandro!
QuimiTube, 10 Años Antes
Tengo una pregunta, como calculas la variación del pH en una solución amortiguadora de CH3COOH/CH3COO- que tiene un pH inicial de 4,62 si adicionas a 2,5 mL de la solución tampón, 0,5 mL de ácido clorhídrico a una concentración de 0,1M, me seria de vital importancia si puedes ayudarme con esto.
Mil Gracias
Julian Trujillo, 10 Años Antes
¡Hola! En ese caso debes hacerlo como un equilibrio, considerando que en el inicio de dicho equilibrio no tienes 0 de H3O+, sino la cantidad de moles que tengas en 0,5 ml 0,1M.
QuimiTube, 10 Años Antes
¿ Que peso de cloruro de amonio debe añadirse a 1L de solucion 0,2 Molar de amoniaco para que su pH sea 9,5 ?
Esteban Quito, 10 Años Antes
Hola Esteban, la idea es que mires el vídeo, aprendas las disoluciones reguladores e intentes hacer el ejercicio tú mismo, preguntando, en todo caso, dudas concretas. Tal vez también te sirva ver este ejercicio:
http://www.quimitube.com/videos/ejercicio-20-calculo-del-ph-de-una-solucion-amortiguadora-por-henderson-hasselbach/
QuimiTube, 10 Años Antes
Hola quisiera saber cuando aplico la ecuación de Handerson es decir que condiciones deben existir. Como se sabe cuando una solución es amortiguadora o no? Siempre que es débil el ácido o la base debe aplicarse el cuadro símil al de equilibrio?
Carla, 10 Años Antes
Hola Carla, tienes una disolución reguladora cuando tienes por ejemplo un ácido débil y su base conjugada, pero no la base conjugada resultante de su disociación parcial, sino adicionada a parte. Es decir, si nosotros preparamos una disolución 1M de ácido acético, y por otro lado preparamos una disolución 1M de acetato sódico, y luego las mezclamos, entonces tienes una disolución reguladora. Lo habitual es que las concentraciones de ambas especies sean iguales o al menos del mismo orden de magnitud. Es en estos casos, cuando tienes una concentración INICIAL apreciable de ambas especies, cuando puedes aplicar la ecuación de Henderson-Hasselbalch. Fíjate que he remarcado la palabra inicial porque son estas concentraciones las que incluimos en la ecuación, no las concentraciones que pueda tener la disolución una vez alcanzado el equilibrio. Espero haber resuelto tu duda. Un saludo.
QuimiTube, 10 Años Antes
muchas gracias x las clases colgadas!!!! estaba buscando por todos lados para enterder algo con la ecua. H-H ….GRACIAS AHORA YA ENTIENDO XQ ALGUNAS COSITAS 😀 ensenas super bien!!
gaby, 10 Años Antes
Muchas gracias a ti por tomarte tu tiempo para comentar. Un saludo grande.
QuimiTube, 10 Años Antes
ok, tal vez a estas alturas suene un poco bobo, pero mi duda aqui es
¿Como calcular el pH de un buffer cuando se le agrega un ácido o una base fuerte?
Si ya tienes un vídeo con explicación, solo dime cuál es,
gracias
J. Axel, 10 Años Antes
¡Hola! No tengo aún ningún vídeo y me parece una buena idea crear uno así, aunque será más adelante. Lo que debes hacer es considerar que en el equilibrio inicial no tienes 0 de H3O+ sino la cantidad correspondiente al ácido agregado. Es decir, lo plantearás similar a como se hace en este ejercicio:
http://www.quimitube.com/videos/ejercicio-19-calculo-del-ph-de-una-solucion-amortiguadora-por-equilibrio
Pero luego consideras que si por ejemplo has agregado 0,1M de ácido tienes 0,1M de H3O+ inicial.
Un saludo.
QuimiTube, 10 Años Antes
Hola amigos una una duda ¿como se resuelve esto? «Sabiendo que los pK del fosfórico son pK1=2,1 pK2=6,8 pK3=12,7 calcular las proporciones de las sig especies: H2PO4- ; HPO-2 ;PO4-3 a ph fisiológico de 7,4
Andres cardenas, 10 Años Antes
Hola Andrés, esto que comentas es bastante complejo porque es de nivel universitario. No me es posible explicarte por aquí… Debes plantear los tres equilibrios posibles, la pérdida del primer protón, la del segundo y la del tercero. Algo así:
H3PO4 + H2O = H2PO4- + H3O+
H2PO4- + H2O = HPO4(2-) + H3O+
HPO4- + H2O = PO4(3-) + H3O+
Tendrás que aplicar cada equilibrio químico con su valor de Ka (tienes pK1, pK2 y pK3) y con el pH que te dan puedes calcular la concentración de H3O+.
QuimiTube, 10 Años Antes
Me gustaría resolver el siguiente problema pero sin utilizar la ecuación de henderson-hasselbalch, ¿es posible hacerlo? gracias y un saludo
Calcular el volumen de disolución de KOH 0.1M que es necesario añadir a 15mL de disolución 0.2M de ácido acético para preparar una disolución amortiguadora de pH=4.82. La constante de ionización del acético es 1.8×10^-5
Publi, 10 Años Antes
¡Hola! Podrías intentar hacerlo como este otro:
http://www.quimitube.com/videos/ejercicio-19-calculo-del-ph-de-una-solucion-amortiguadora-por-equilibrio
Es decir, planteando el equilibrio acético-acetato.
Inténtalo así y me comentas si no te sale…
Un saludo.
QuimiTube, 10 Años Antes
Gracias por el video pero lamentablemente sigo sin ser capaz de hacerlo
Publi, 10 Años Antes
hola profe.. sigo sin entender de donde obtenemos el valor ka.. es una constante?? nos la dan siempre? y si nos las dan como la calculamos???
mar, 10 Años Antes
¡Hola! Sí, es una constante que o bien te deben dar en el enunciado o bien te dan una tabla como esta:
http://www.quimitube.com/wp-content/uploads/2012/03/Tabla-de-Ka-y-Kb.pdf
QuimiTube, 10 Años Antes
Hola,perdona no entiendo cual es la funcion del CH3COONa, me lo podrias explicar rapidamrnte?
Gracias.
Monsef, 10 Años Antes
Llevo todo el curso con problemas en la materia de química por culpa de la profesora que, a parte de tenerme manía, no explica nada y cuando lo hace no se la entiende. Gracias a ti podré recuperar los 8 y 9 que sacaba antes.
David, 10 Años Antes
Hola David, mucho ánimo para recuperar esas notas, con dedicación seguro que lo logras. Un saludo grande.
QuimiTube, 10 Años Antes
Buenas, me preguntaba como se puede saber en ejercicios de segundo de bachillerato y en los de selectividad si no te suelen mencionar que el ácido o la base están disueltos en agua y por tanto podamos usar la formula de pH + pOH =14
Miguel Sanchez, 10 Años Antes
Hola Miguel, no he visto nunca un ejercicio de ácido base ni en bachillerato ni en selectividad en el que no estuviese disuelto en agua, ya que toda la química ácido base que se da en este nivel es en disolución acuosa por definición (fíjate que por ejemplo cuando tenemos un ácido escribimos HA + H2O = A- + H3O+). Dudo mucho, por no decir que es prácticamente imposible, que te pusiesen algo que no fuese en agua y, por supuesto, si no lo mencionan estás en agua. Ahora bien, es posible que pH + pOH sea distinto de 14 porque no estemos a 25ºC sino a otra temperatura distinta en la que Kw cambia. Mira este ejemplo:
http://www.quimitube.com/videos/ejercicio-13-variacion-del-producto-ionico-del-agua-con-la-temperatura
QuimiTube, 9 Años Antes
Hola. Me dicen: Tengo una solucion 100mM de Na2HPO4 y otra de 100mM de NaH2PO4. Calcular la cantidad de estas soluciones que tiene que mezclar para obtener 100ml de buffers con los siguientes pHs: 8,2 – 7,4. ¿como debo hacer?
Maria Parra, 9 Años Antes
¡Hola! Tendrás una concentración de HPO4(2-) y otra concentración de H2PO4(-). Con la ecuación de Henderson-Hasselbalch puedes calcular la relación de concentraciones que necesitas tener para cada unos de los pH que te indican (también necesitarás el pKa de HPO4(2-)) y con esa relación de concentraciones para cada pH podrás ver qué volumen necesitas de cada disolución inicialmente.
Mira este vídeo:
http://www.quimitube.com/videos/ejercicio-20-calculo-del-ph-de-una-solucion-amortiguadora-por-henderson-hasselbach
QuimiTube, 9 Años Antes
Hola, excelente video! una consulta como se hace para calcular la cantidad de KH2PO4 Y K2HPO4, que se necesitarian para preparar 100 ml del buffer, con una concentración de 0,15 mol/l de manera que su pH regulado sea 7,21?
gracias 🙂
Jocelyn, 9 Años Antes
¡Hola Jocelyn! Prueba a aplicar la ecuación de Henderson-Hasselbalch, en la que usas la relación de concentraciones de ambas especies:
http://www.quimitube.com/videos/ejercicio-20-calculo-del-ph-de-una-solucion-amortiguadora-por-henderson-hasselbach
Lo que no sé bien es si la concentración de 0,15 mol/l se refiere a la suma total o a cada una de ellas.
QuimiTube, 9 Años Antes
Hola, primero que todo, muchas gracias por los vídeos, de verdad me han servido de mucho!! Por favor tengo un ejercicio que no entiendo :(, es similar a uno que esta mas arriba en los comentarios, pero me preguntan por algo distinto. Dice así: «calcular pH de una solución de ácido fosfórico 0,02 M, sabiendo que pk1=2,12 , pk2=7,21 y pk3=12,36.»…. Se que es difícil de resolver , pero nada mas quiero una directriz para resolver este problema, ojala me pueda ayudar :s Saludos!!!
Guillermina, 9 Años Antes
Hola Guillermina, a ver si más adelante tengo ocasión de grabar este tipo de ejercicios que son de nivel universitario… Debes plantear los 3 equilibrios posibles de pérdida de un protón por parte del ácido, es decir:
H3PO4 + H2O = H2PO4- + H3O+
H2PO4- + H2O = HPO4(2-) + H3O+
HPO4- + H2O = PO4(3-) + H3O+
Cada uno de estos equilibrios tiene el valor de la constante que te han indicado, que puedes calcular con el pK1, pK2 y pK3. Puedes calcular la concentración de H3O+ sabiendo que la concentración de todas las especies de ácido fosfórico presentes en el equilibrio será igual a la concentración inicial total de ácido fosfórico, 0,02M. Es decir:
[H3PO4]eq + [H2PO4-]eq + [HPO4(2-)]eq + [PO4(3-)]eq = 0,02
QuimiTube, 9 Años Antes
Entonces, la funcion de las disoluciones amortiguadoras es la misma que la de compuestos con un ión común?
Víctor, 9 Años Antes
Hola Víctor, es que en muchas ocasiones si incluyes un compuesto con un ion común ya estás formando la disolución reguladora. Entiendo que te refieres a que tenemos por ejemplo ácido acético y luego un compuesto que sea un acetato, cuyo ion común sería el CH3COO-. Un saludo.
QuimiTube, 9 Años Antes