Contenido del Vídeo
Como hemos visto en la introducción a las propiedades de las sustancias covalentes, las sustancias moleculares se componen de moléculas individuales, entre las cuales se establecen fuerzas intermoleculares, es decir, fuerzas de carácter débil, muchísimo más débiles que los propios enlaces covalentes intramoleculares.
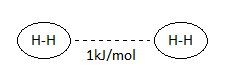
Por ejemplo, si consideramos la molécula de hidrógeno, H2, el enlace intramolecular es un enlace covalente, muy fuerte, en el que cada hidrógeno comparte su único electrón, y cuya estructura de Lewis será, sencillamente, H – H.
Este enlace tiene una energía de 435 kJ/mol. No obstante, entre las distintas moléculas de H2, se establecen fuerzas intermoleculares que, aunque se dan, son muy débiles, en este caso de 1 kJ/mol (más de 400 veces más débiles que el enlace covalente). Estas fuerzas, como veremos en profundidad en otro apartado, reciben el nombre de fuerzas intermoleculares dipolo instantáneo-dipolo inducido, o también fuerzas de London o de dispersión.
El hecho de que estas fuerzas intermoleculares sean débiles hace que, en general, las sustancias moleculares covalentes sean gaseosas a temperatura ambiente, porque hay que aportar poca energía para separar unas moléculas de otras y, por tanto, para fundirlas y evaporarlas. No obstante, existen factores que pueden hacer que estas fuerzas intermoleculares aumenten y que, por tanto, algunas sustancias covalentes moleculares sean sólidas o líquidas a temperatura ambiente, a pesar de estar formadas por moléculas independientes. Estos factores son, esencialmente, dos: la masa molecular y la polaridad global de la molécula.
- Masa molecular. A mayor masa molecular, mayores son las fuerzas intermoleculares, aunque se trate de moléculas muy semejantes en cuanto a su estructura. Por ejemplo, en el grupo de los halógenos, el flúor y el cloro son gases, el bromo es líquido y el yodo, sólido.
- Polaridad molecular. Si las moléculas covalentes son polares, se unirán las unas a las otras más fuertemente que si son apolares. Esto se debe a que establecerán entre ellas fuerzas electrostáticas, y por tanto será más difícil separarlas y habrá que aportar más energía (mayores temperaturas de fusión y de ebullición).
Recordemos que las moléculas covalentes pueden ser polares cuando sus enlaces presentan momentos dipolares permanentes que no se anulan por geometría, y que un enlace es polar si existe una diferencia de electronegatividad entre sus átomos.
También de la polaridad molecular dependerá la solubilidad, es decir, del tipo de disolventes en los cuales es soluble la sustancias. Los compuestos covalentes polares son solubles en disolventes polares (agua, etanol…) y los compuestos covalentes apolares serán solubles en disolventes apolares.
Así, resumiento, las propiedades físicas de las sustancias covalentes moleculares son:
- Están formadas por moléculas independientes unidas entre sí por fuerzas débiles llamadas fuerzas intermoleculares.
- Hallamos sustancias covalentes moleculares que a temperatura ambiente se hallan en estado gaseoso, otras en estado líquido y otras en estado sólido, dependiendo de la fortaleza de dichas fuerzas intermoleculares. No obstante, en general, presentan puntos de fusión y ebullición bajos, menores de 300º en todo caso.
- Solubilidad dependiente de su polaridad. Los polares son solubles en disolventes polares como agua o etanol, los apolares en disolventes apolares como benceno o hexano.
- No conducen la corriente eléctrica o son muy malos conductores de la misma, porque los electrones se hallan muy localizados, y son moléculas independientes. Únicamente la conducen los compuestos covalentes muy polares en disolución acuosa que se puedan disociar como electrolitos, como el HCl, cloruro de hidrógeno, que disuelto en agua se disocia como H+ y Cl- y recibe el nombre de ácido clorhídrico (porque libera protones, H+).
Category: Enlace Químico y Teoría de Enlace Químico.
Etiquetas: Enlace covalente.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
GRACIAS POR SUS APORTES YA QUE EXPLICA DE UNA FORMA MUY SENCILLA AL ALCANCE DE TODOS PARA SER ENTENDIDO FÁCILMENTE, ADEMÁS SON CONCRETOS LA FELICITO PORQUE EDUCAR ES UNA OBRA MARAVILLOSA.
claudia, 11 Años Antes
Muchas gracias Claudia, me alegra mucho que te sirva.
QuimiTube, 11 Años Antes
es muy buena respuesta a es perugunta de mi tarea muchas garxias por eso amigos tkm :*
natalia, 11 Años Antes
es algo muy buena la respuesta pero hay algo q agregarle ok
ana, 10 Años Antes
¡Hola! Este es solo un vídeo de los muchos que tenemos sobre enlace covalente, ahí tienes todo completo sobre este tipo de enlace:
http://www.quimitube.com/videostags/enlace-covalente
QuimiTube, 10 Años Antes
Hola porque si el oxigeno es soluble en agua, las peceras tienen aireadores, sin el aireador el agua se quedaria sin oxigeno.
daniela, 10 Años Antes
Hola Daniela, el oxígeno no es muy soluble en agua, solo muy levemente y dependiendo de la temperatura. Ten en cuenta que es una sustancia covalente apolar, y el agua es polar, por lo que su miscibilidad es muy pequeña. Por eso las peceras necesitan tener aireadores.
QuimiTube, 10 Años Antes
De las siguientes características cuales corresponden a las sustancias covalentes?
1. La mayoría son combustibles
2. A temperatura ambiente son sólidos.
3. Funden a temperaturas mayores a 350°
4. Suelen disolverse mejor en solventes orgánicos
5. Es común encontrar átomos de carbono en su moléculas
Si alguien fuera tan amable de rwaponerme lo apreciaría mucho no puedo con esa pregunta hace horas
Mauricio, 9 Años Antes
Hola Mauricio, precisamente en nuestro vídeo explicativo y en la explicación escrita a pie de vídeo puedes tener las respuestas a esas preguntas. Es la mejor ayuda que te podemos ofrecer, míralo e intenta resolverlo (si nosotros te respondemos simplemente no aprenderás nada). Un saludo.
QuimiTube, 9 Años Antes