Contenido del Vídeo
Las redes covalentes son sustancias macromoleculares, formadas por un número muy elevado de átomos iguales o distintos, unidos entre sí por enlaces covalentes, es decir, enlaces muy fuertes. En la naturaleza existen diversas redes covalentes, de las cuales consideraremos dos formas alotrópicas del carbono (grafito y diamante) y la sílice, óxido de silicio (SiO2). Puesto que son redes con gran cantidad de átomos unidos muy fuertemente, son sólidos a temperatura ambiente y, además, sus puntos de fusión y de ebullición son altísimos. Vemos los puntos de fusión para las tres redes covalentes comentadas:
- C (diamante) = 3823 K
- C (grafito) = 3800 K
- Sílice (SiO2) = 1986 K
Estos puntos de fusión y ebullición son muy altos, porque para fundirlos es necesario romper la red cristalina de enlaces covalentes.
Además son compuestos en general muy duros (el diamante es el compuesto más duro que se conoce, con una dureza de 10 en la escala de Mohs) a excepción del grafito, que tiene una dureza de 1-2 por su peculiar estructura en capas. Por el mismo motivo, su estructura en capas, el grafito es el único capaz de conducir la corriente eléctrica.
Todos ellos son insolubles en prácticamente cualquier disolvente.
A continuación veremos con mayor detalle las estructuras del grafito y del diamante.
Estructura del grafito y propiedades
Aunque el grafito está formado por carbono, igual que el diamante (son dos formas alotrópicas del mismo elemento, es decir, con distinta estructura), las diferencia en la forma en que se enlazan dichos átomos de carbono en ambas estructuras les confiere propiedades totalmente distintas (de hecho, sabemos que el grafito, la mina de lápiz, es un material barato, mientras que el diamante vale un potosí).
La estructura del grafito está formada por capas planas de áto, mos de carbono con hibridación sp2, formando hexágonos, en los que cada átomo de carbono está en el centro de un triángulo equilátero y unido a otros tres átomos de carbono, que serían los vértices del triángulo. Estos enlaces son C-C de tipo sigma, σ, entre un orbital sp2 de un carbono y el orbital sp2 del carbono vecino, y su distancia es de 0,142 nm. Esta distancia es el valor intermedio entre un enlace simple y un enlace doble, debido a que hay una serie de enlaces pi deslocalizados por encima y por debajo del plano de hexágonos.
¿A qué se deben estos enlaces pi deslocalizados? Puesto que tenemos hibridación sp2 para los átomos de carbono, esto implica que cada uno de ellos tendrá un obital p sin hibridar, que albergará un electrón desapareado. La configuración electrónica de un carbono sp2 es:
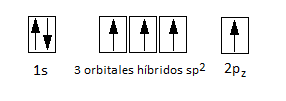
Como hemos dicho, este orbital p es perpendicular al plano de los hexágonos, y se superpone lateralmente con los 3 orbitales 2p de los átomos de carbono vecinos, de forma que la densidad electrónica se distribuye por encima y por debajo de las capas de hexágonos. Después, estas capas se apilan las unas sobre las otras, pero se trata de enlaces débiles, y por este motivo es un compuesto blando. La distancia entre capas es muy grande, de 0,35 nm.
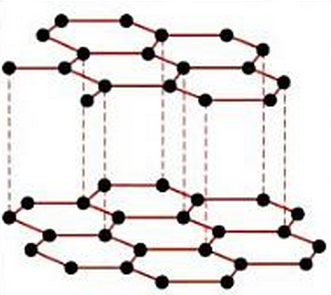
Puesto que las capas, como decimos, se unen débilmente entre sí, el grafito es exfoliable y untuoso al tacto. La exfoliación es lo que permite que el grafito se use para dibujar como mina de lápiz, ya que al frotar la mina sobre el papel se van desprendiendo capas. Además, por esta capacidad exfoliante, se usa como lubricante en seco.
Cabe añadir, finalmente, que el grafito es conductor de la electricidad y, como vimos en el tema de oxidación-reducción, se puede usar como electrodo inerte en pilas galvánicas o en celdas electrolíticas.

Botella de plástico con electrodos caseros de grafito para electrolizar cloruro sódico(sal común): producción de lejía casera.
Estructura del diamante y propiedades
El diamante es otra forma natural de carbono puro, pero en este caso está constituida por una red de átomos de carbono con hibridación sp3. Estos átomos de carbono se unen entre sí por enlaces de tipo sigma, σ, cuya distancia es de 0,154 nm (correspondiente a un enlace simple C-C). Los átomos de carbono presentan geometría tetraédrica, de forma que cada átomo de carbono se une a otros cuatro átomos situados en los vértices de un hipotético tetraedro, y así sucesivamente en las tres dimensiones. Cada carbono de estos vértices es, a su vez, el átomo central de otro tetraedro. Por tanto, todo el cristal se puede considerar como una molécula gigante o macromolécula.
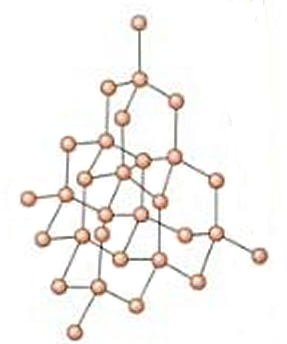
Puesto que los enlaces sigma carbono-carbono son muy fuertes, el diamante se caracteriza por su gran dureza y por sus elevados puntos de fusión y ebullición, además de no conducir la corriente eléctrica y ser insoluble.
Otro compuesto de estructura semejante al diamante y también de elevada dureza es el carburo de silicio, SiC, llamado también industrialmente carborúndum, con disposición tetraédrica tanto de los átomos de silicio como de los átomos de carbono.
Category: Enlace Químico y Teoría de Enlace Químico.
Etiquetas: Enlace covalente.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Excelente explicación, te felicito me sirvió mucho gracias
Bianka, 11 Años Antes
Gracias a ti por comentar y bienvenida.
QuimiTube, 11 Años Antes
A mi no me sirbio
Miquel, 6 Años Antes
Hola, lamento que no te sirviera, quizá busques contenidos para un curso más bajo, esto es para segundo de bachillerato.
QuimiTube, 4 Años Antes
De verdad nos ayudas bastante con tus videos! Muchas gracias
Brenda, 11 Años Antes
De nada Brenda, me alegra que te sirvan 🙂 Un saludo y bienvenida
QuimiTube, 11 Años Antes
gracias por la explicación explicas mejor que todos mis maestros
xavier, 11 Años Antes
Muchas gracias Xavier por tu comentario, me alegro mucho de que te guste 🙂 Un saludo
QuimiTube, 11 Años Antes
Hola!quería saber la razón por la que grafito y diamante son insolubles mientras que los fulleranos son solubles?:-)
Andrea, 11 Años Antes
¡Hola! El grafito y el diamante son redes muy grandes formadas por una cantidad muy grande de átomos unidos por enlaces covalentes, que son extremadamente fuertes, y esto es lo que hace que no sean solubles. En el caso de los fullerenos tienes también enlaces covalentes de una gran fortaleza, generalmente sp2, como en el grafito, pero ocurre que ya no son tantos átomos, su masa molecular es mucho menor, y esto hace que puedan ser solubles. Esto, la menor masa molecular, unida al hecho de que los orbitales p que no se hibridan quedan expuestos al disolvente por geometría y pueden interaccionar con el agua, solubilizándose (fuerzas de van der Waals).
QuimiTube, 11 Años Antes
Excelente! La verdad espectacular esta información y muy bien explicado el tema, me sirvió mucho. Seguí así!!!
Carlos, 11 Años Antes
Muchas gracias Carlos, me alegro que te guste el material y te agradezco que te hayas tomado tu tiempo para dejar un comentario. Un saludo muy grande.
QuimiTube, 11 Años Antes
Es de grandiosa la ayuda de estos videos y explicaciones , les felicito por tan grande labor , desde Nicaragua les saluda….
mary
maria noguera, 11 Años Antes
Mil gracias Mary, me alegro mucho de que te gusten, la verdad es que es una labora muy bonita. Un saludo muy grande.
QuimiTube, 11 Años Antes
Me sirvio de mmmmmuuuuuucccchhhhoooo
Gracias 7u7
karina, 11 Años Antes
De nada 🙂
QuimiTube, 11 Años Antes
muy bien si que sabes explicar deberias ser profesor
clara, 11 Años Antes
Muchas gracias Clara, me alegra que te guste 🙂
QuimiTube, 11 Años Antes
Estoy preparando un final d quimica inorganica y tu explicacion me sirvio muchisimo, me gustaria, si es posible, que direras una explicacion de la estructura del diborano, gracias!
dani, 11 Años Antes
¡Hola Dani! Gracias, me alegra que te sirva. Intentaremos crear una entrada de blog con la explicación del diborano, aunque ahora mismo nos es un poco difícil. Un saludo.
QuimiTube, 11 Años Antes
genial, me sirvio para la tarea de investigacion muchas gracias me saque un 100% 🙂
Paula, 10 Años Antes
Hola! Quería saver si el diamante y el grafito se consideran covalentes polares, es que no tengo claro, por es urgente..
lady12, 10 Años Antes
¡Hola! Lo siento me es posible responder con urgencia a las preguntas, se acumulan muchas. No son covalentes polares, porque están formadas por el mismo tipo de átomos (misma electronegatividad). De todas formas «covalentes polares» o «covalentes apolares» se suele aplicar a moléculas covalentes y esto es un sólido covalente.
QuimiTube, 9 Años Antes
hola buenas tardes
mediante globos u otro meterial, modelos que representen cada una de las formas de hibridacion del carbono.
yorleidis hoyos, 9 Años Antes
Hola, intuyo que quieres saber cómo podrías hacerlo… Aquí teines por ejemplo la hibridación del CH4:
http://www.quimitube.com/videos/modelo-del-enlace-de-valencia-hibridacion-sp3-del-metano-y-el-etano
Ahí abajo verás el dibujito y podrás representarlo con globos.
QuimiTube, 9 Años Antes
como podria hacer una maqueta de esto?
mauri, 9 Años Antes
Te pueden servir los modelos moleculares:
http://www.quimitube.com/modelos-moleculares
QuimiTube, 9 Años Antes
tengo dudas respecto al grafito. Si vemos al grafito; sus átomos de carbono alcanzan a «poseer» 7 electrones, pero les falta uno para alcanzar el octeto y ser estables, yo pienso que ese electrón faltante lo pueden conseguir de la capa inferior o superior (recordando que el grafito esta formado por capas) y así se volvería estable pero si eso pasa entonces ya no puede tener estructura exagonal y tendría que convertirse en diamante que es la forma estable, entonces. ¿porque el grafito que seria inestable (ya que sus carbonos solo tienen 7 electrones) existe si se puede estabilizar rápidamente compartiendo un electrón de la capa inferior o superior?. ¿Acaso eso no es lógico?. ¿porque prefiere que sus capas se unan mediante fuerzas de vanderwals y no mediante enlaces covalentes que lo estabilizarían adecuadamente?
Camilo, 9 Años Antes
¡Hola Camilo! Los átomos del grafito no tienen 7 electrones en su última capa, tienen 8, porque su hibridación es sp2. Esto significa que el electrón que queda solo en el orbital p está formando enlace, solo que no se trata de un enlace sigma (que parece que es lo que tú identificas como enlace en sí, pero el p también es un enlace perfectamente válido). Los enlaces pi de orbitales p-p de dos átomos de grafitos contiguos hacen que los átomos tengan 8 electrones en la última capa, es estable y completo. De hecho, esos enlaces pi presentan el fenómeno de la resonancia, es decir, se pueden deslocalizar como ocurre en el caso del benceno, lo cual le da una estabilidad adicional. Te recomiendo ver precisamente este caso, el del benceno:
http://www.quimitube.com/videos/hibridacion-sp2-con-enlaces-pi-deslocalizados-benceno
Esto es dentro de la propia capa plana, posteriormente sí que se unen las distintas capas con fuerzas de Van der Waals, pero los enlaces dentro de los átomos de las capas son covalentes y profundamente estables (basta que veas que es el fundamento del grafeno).
Un saludo
QuimiTube, 9 Años Antes
Deverdad muchas gracias por contestarme, lo agradezco desde el fondo de mi corazón T_T …. Me surge esta duda con su respuesta :c
http://fotos.subefotos.com/fba828f8eaee5a6da7b30c74340b78a3o.png
Camilo, 9 Años Antes
con el benceno no ocurre lo que explica la imagen
Camilo, 9 Años Antes
Holaaaaaaa…. En cuanto la cristalización en el sistema cúbico del diamante; ¿es centrada en el cuerpo (celda unitaria b.c.c)? o centrada en las caras (celda unitara f.c.c)
Camilo, 9 Años Antes
Hola,queria saber ¿por que se derriten los metales y el diamante no?
Pablo, 9 Años Antes
Hola Pablo, por sus distintos enlaces químicos, en el diamante una red covalente y en los metales enlace metálico. Las propiedades de ambos tipos de enlaces son distintas.
QuimiTube, 9 Años Antes
Muy bueno el video. Estudio ingenieria quimica y la verdad que me ayudas mucho, segui asi!
Tomas, 9 Años Antes
Gracias Tomás, me alegra que te sirva. Mucha suerte con tus estudios.
QuimiTube, 9 Años Antes
Excelente explicación!!
Ezequiel, 6 Años Antes
¡Gracias!
QuimiTube, 4 Años Antes
Como se crea el grafito y el diamante en su forma natural
Britney, 5 Años Antes
¡Hola! El diamante se forma por elevadas presiones en el interior de la Tierra, ya que el grafito es más estable y para su paso a diamante se requieren presiones y temperaturas muy elevadas.
QuimiTube, 4 Años Antes
Hola, quisiera saber información sobre la furza de unión entre sus átomos
Jorge, 4 Años Antes
Hola Jorge, te sugiero que veas el vídeo con atención y leas el comentario a pie de vídeo. Ahí está explicado a fondo, gracias.
QuimiTube, 4 Años Antes
Ayuda porfavor, me podrías decir que tipo de interacción debe romperse para fundir el grafito? Gracias..
Ayuds, 4 Años Antes
Hola, como ves en el vídeo el grafito es una red covalente muy particular. Tienes que romper las interacciones electrostáticas entre las distintas capas y si sigues aportando energía podrías llegar a romper los enlaces carbono-carbono covalentes que hay dentro de las propias capas. Un saludo.
QuimiTube, 4 Años Antes
Hola, no termino de entender por qué es que los sólidos iónicos tienen un punto de fusión generalmente menor a los sólidos covalentes en red. Por qué la red de enlaces covalentes es más fuerte a la de interacciones electrostáticas?
Widukindo, 4 Años Antes
¡Hola! Bueno, esto esencialmente lo sabemos por las mediciones experimentales. Es posible a nivel experimental determinar la energía de un enlace carbono-carbono en una red, de hecho se conocen estos valores. Las interacciones electrostáticas pueden ser muy fuertes, especialmente si los iones son polivalentes, pero realmente nada es tan fuerte como un enlace covalente. Ten en cuenta que el diamante es el compuesto más duro y otros que rivalizan con él, como el carburo de silicio, son también enlaces covalentes. Un saludo.
QuimiTube, 4 Años Antes