Contenido del Vídeo
Las reacciones de oxidación-reducción (también llamadas reacciones redox o reacciones de transferencia de electrones), reciben este nombre porque al principio los químicos clasificaron dentro de este tipo únicamente la reacción de ciertas sustancias con el oxígeno. Por ejemplo, la reacción del hierro con el oxígeno:
![]()
Así, a este tipo de reacciones las llamaron reacciones de oxidación, mientras que llamaron reacciones de reducción a aquellas reacciones en las que una sustancia perdía oxígeno. Por ejemplo, la reacción del óxido de cobre(II) con el hidrógeno:
![]()
Sin embargo, a medida que la química avanzó, se observó que la transformación que sufre el hierro en la reacción con oxígeno, es decir, pasar de hierro metálico al catión hierro(2+), puede sufrirla por reacción con otros elementos. Por ejemplo:
![]()
La transformación que ha sufrido el hierro en su reacción con oxígeno y en su reacción con cloro es la misma, por lo que, por analogía, a esta segunda reacción también se la denomina reacción de oxidación, a pesar de que no hay intervención de oxígeno en la misma.
Por tanto, ¿cómo podemos definir de una forma amplia las reacciones de oxidación reducción? Se definen en términos de transferencia de electrones.
- Oxidación: reacción en la que una sustancia pierde electrones.
- Reducción: reacción en la que una sustancia capta electrones.
Es importante destacar que si una sustancia está perdiendo electrones en una reacción de oxidación, necesariamente tiene que haber otra sustancia que los gane, de forma que ambas reacciones, las reacciones de oxidación y las reacciones de reducción, son reacciones complementarias. No puede haber una oxidación sin una reducción y viceversa, de forma que en una reacción química redox una sustancia se comporta como un oxidante y una sustancia se comporta como un reductor:
- Oxidante: sustancia capaz de producir una oxidación, es decir, que puede captar electrones de otra. Puesto que el oxidante capta electrones, durante el proceso se está reduciendo.
- Reductor: sustancia capaz de producir una reducción, es decir, que puede ceder electrones a otra. Puesto que está perdiendo electrones en el proceso se está oxidando.
Cuando un oxidante reacciona se reduce (gana electrones), mientras que cuando reacciona un reductor se oxida (pierde electrones).
Consideremos la reacción entre el catión Cu2+ y el zinc metálico (con estado de oxidación 0, Zn0). Se dispone de un vaso de precipitados que contiene una disolución de Cu2+ y, en dicha disolución, se introduce una barra de zinc metálico. Cuando ponemos en contacto ambos reactivos se produce la siguiente reacción de oxidación-reducción:
![]()
Una cierta cantidad de cobre metálico se deposita en la superficie de la barra de zinc y una cierta cantidad de catión Zn2+ pasa a la disolución.
Se trata de una reacción de oxidación-reducción puesto que, como podemos ver, el cobre ha pasado de Cu2+ a Cu0 (ganando 2 electrones), mientras que el zinc ha pasado de Zn0 a Zn2+ (perdiendo 2 electrones). Dado que el Cu2+ gana electrones se está comportando como un oxidante y, a su vez, se está reduciendo; por su parte, puesto que el Zn0 pierde electrones, se está comportando como un reductor y, a su vez, se está oxidando. A cada una de estas dos reacciones complementarias se las denomina semirreacciones (semirreacción de oxidación y semirreacción de reducción):
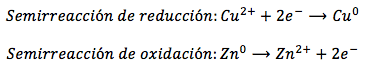
De forma general, cualquier reacción de oxidación-reducción se puede escribir como:
![]()
Los pares oxidante 1/reductor 1 y oxidante 2/reductor 2 reciben el nombre de pares redox conjugados. Por ejemplo, el par Cu2+/Cu0 o el par Zn2+/Zn0.
Category: Teoría Oxidación Reducción y Vídeos Redox.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Estoy preparando de nuevo selectividad para subir nota (voy a por el 10 jeje), y la verdad es que tus videos son de lo mejorcito que he encontrado por internet para preparar Redox y ácido base, los temas más dificiles.
Tienes algún material o podrías recomendar algo para preparar de 10 la termoquímica y los temas de átomos y enlaces (más teóricos estos últimos)?
Se agradecería mucho.
Saludos!
Cephalopod, 13 Años Antes
¡Hola! ¡Gracias por la parte que me toca! 🙂 Me alegro mucho de que vayas a por el diez con tanto ahínco y espero que lo consigas; si además yo te sirvo de ayuda, ya sería el colmo.
Siento mucho no tener nada de termoquímica ni de enlace, todavía no me ha dado tiempo 🙁 He empezado este año con este proyecto y como ves sólo he podido dedicarme a ácido base y a redox porque, como tú bien dices, son los más difíciles.
Sólo puedo recomentarte apuntes de otros «colegas» que también comparten por internet. A mí me parece que tienen buena pinta, aunque lo cierto es que sólo les he echado un vistazo rápido. Son: el profesor Díaz Escalera, que pone ejercicios con soluciones en pdf; también lo hace así otro profesor, Lisardo Bello; por último, hay una academia que cuelga muchos vídeos de bachillerato en Youtube, entre ellos química, que se llama AINTE, y por lo que yo he visto ponen bastantes ejercicios resueltos.
No estoy muy segura de que te sirva, pero no sé qué más recomendarte…
Ah, bueno, también hay un libro que yo tengo desde la época en que hacía bachillerato, de Everest. Se llama «1000 problemas de Química General», y es una joya. Sobretodo si vas a cursar una carrera que tenga química en primero, es estupendo.
Quimitube, 13 Años Antes
Gracias por la información, le echaré un ojo, aunque primero quiero acabar dominar redox y ácido-base, que es lo que siempre se me atragantó más. Si tengo alguna duda sobre tus videos te la haré saber.
Ah, y lo menos que puedo hacer es, despés del examen, dedicarte un enlace desde una web que tengo con bastantes visitas diarias.
Ya te avisaré cuándo lo haga.
Saludos
Cephalopod, 13 Años Antes
Impresionante el trabajo monumental que estás haciendo. Cuánto te lo agradecemos. IES JM THOMAS
Alberto, 12 Años Antes
No sabéis la ilusión que me ha hecho este comentario… Me da mucha fuerza para seguir grabando si sé que de verdad sirve de ayuda. ¡Muchísimas gracias!
Quimitube, 12 Años Antes
La verdad que es una herramienta de ayuda muy eficiente! El buen uso de la tecnología es la clave para el entendimiento. Y enseñar prolijamente de esta innovadora forma, es un perfecto ejemplo de primero el compromiso que toman ante otros de ser maestros y de segundo ayudar a mucha gente en algo tan importante que es la formación académica que va de la mano de la formación del ser.
Los felicito por este emprendimiento y esperemos que sea ejemplo de muchos mas.
juan pablo, 12 Años Antes
Muchísimas gracias por la felicitación y bienvenido 😀
Esperemos que la Educación del futuro vaya siempre hacia adelante, siempre ayudando a formar a la persona y al ser, como bien has dicho.
Un saludo,
Carmen
Quimitube, 12 Años Antes
muchas gracias por la enseñanza, es quí donde termino de enterder las clases de química de la uni…Dios te bendiga…gracias!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!
angela, 12 Años Antes
De nada, me alegro muchísimo que te sean de ayuda nuestras explicaciones 😀 Si tienes alguna consulta no dudes en pregunta. Un saludo y bienvenida.
Quimitube, 12 Años Antes
muy buena pagina,excelente la guia de ejercicios resuelto en videos. La verdad muy buena voy a recomendar la pagina a todos mis compañeros ejje. Saludos
Franco, 12 Años Antes
Hola Franco, bienvenido. Me alegro mucho de que te sirva de ayuda y te agradezco profundamente que recomiendes nuestra página a tus compañeros, nos das un empujón enorme 😀 Ya sabes que si tienes cualquier duda puedes preguntar.
Un saludo,
Carmen
QuimiTube, 12 Años Antes
Me encanta tu página!! Voy a volver a presentarme a química este año para subir nota,porque yo ya me examiné hace 12 años pero quiero entrar en otra carrera y tengo la opción de subir nota, y vete a saber dónde quedaron mis conocimientos…
Muchas gracias por este gran trabajo!! Ánimo!!
PAtricia, 12 Años Antes
Gracias Patricia, me das muchos ánimos con tu comentario. Seguro que tus conocimientos están más cerca de lo que piensas, sólo hay que sacarlos un poquito a la superficie… 😀 Mucha suerte con presentarte de nuevo, espero que aquí lo encuentres todo para ir a por el 10!! Cualquier duda que tengas puedes consultar. Un saludo grande, Carmen.
QuimiTube, 12 Años Antes
Maestra ¿sería tan amable de ayudarme con unas prácticas de laboratorio para óxido-reducción? el objetivo es que mis alumnos hagan algo que les pueda servir o llevarse a su casa, es decir, no sea una práctica que no les sirva el producto final, mire por ejemplo cuando veo con mis alumnos reacciones ácido-base, con ellos hacemos detergente y analizamos que también es exotérmica, etc. Muchas gracias.
Victor Hugo Cerecedo Díaz, 12 Años Antes
¡Hola! Le echaré un vistazo en cuanto tenga un momentito y te comento, aunque quizá la de fabricar una pila con un limón es muy útil porque no es peligrosa, aunque tendrá el inconveniente de que se necesita un electrodo de zinc que no es fácil de conseguir. Por lo demás, bastaría hilo de cobre, limón, un soporte para bombilla y una bombilla para llevarla a cabo, como aparece aquí:
http://www.quimitube.com/fabricacion-de-una-pila-daniell-con-un-limon/
También está la de fabricar lejía casera, pero no creo que eso se lo puedan llevar a casa, aunque si los alumnos nos son muy pequeños igual sí pueden llevar su propia lejía para limpiar:
http://www.quimitube.com/fabricacion-de-hipoclorito-sodico-lejia-casera-con-una-pila-y-agua-con-sal/
Si se me ocurre algo más te comento.
Gracias por comentar y bienvenido 🙂
QuimiTube, 12 Años Antes
ola felicito los tutoriales de quimica weno a mi por lo general me gusta la quimica ehh ¿se puede hacer preguntas para que me ayuden en los temas que no este tan bien ?
DANIEL, 12 Años Antes
¡Hola Daniel! Bienvenido y gracias por la felicitación. Por supuesto puedes preguntar tus dudas e intentaremos responderlas en cuanto tengamos un hueco. Un saludo.
QuimiTube, 12 Años Antes
Hola! yo otra vez ….. 😉
Bueno tengo un lio con esta ecuacion!!! no me da………..
NH3 + O2 —- NO + H2O
ocurren dos sem reduccion? O2 con NO & H2O??
lo siento, creeme que no quiero molersar tanto pero aveces no hay otra salida 🙁
Un saludos grande!
Dayana, 12 Años Antes
Hola! 🙂 En primer lugar muchas gracias por tus explicaciones, son estupendas!. Me gustaría también plantearte dos dudas. Cuando ajustas una reacción redox, ¿qué compuestos separas en sus iones? (sales, ácidos…??). Y mi otra pregunta es que si existe alguna metodología para una vez has obtenido la reacción iónica ajustada de una reacción redox, pasarla a su reacción molecular. (cuando no te dan nigún ácido el enunciado de un problema, ¿puedes añadir cualquiera?, ¿cómo se haría la reacción en ese caso?) Muchisimas gracias, y enhorabuena por la web 🙂
Lucía, 12 Años Antes
Hola Lucía 🙂 Bien, los ácidos generalmente se separarán siempre porque además en redox aparecen normalmente ácidos fuertes, que se disocian por completo. En cuanto a las sales, lo habitual es que también se disocien, aunque existen algunas sales insolubles, como los óxidos, por ejemplo los de manganeso, que deben permanecer como una especie completa ya que no se separa en iones en agua.
En cuanto a lo del paso de la iónica a la global no se me ocurre una metodología concreta, en realidad es más una cuestión de tanteo. Si, como tú dices, no te dan el ácido, será suficiente un ácido fuerte en el que el anión no intervenga en la redox, es decir, que no se oxide o se reduzca antes que otras de las especies presentes que hemos planteado. Lo habitual es que sean clorhídrico, HCl, ya que el Cl- cuesta mucho de oxidar, o el sulfúrico, H2SO4. El nítrico, por ejemplo, HNO3, ya no es tan recomendable porque el nitrato es un buen oxidante y podría ser mejor oxidante que el que estés utilizando. En un caso así, en el que añades un ácido cualquiera, realizarías todo igual y al llegar a la iónica, para pasar a la global usarías el ácido elegido.
Espero que se comprenda.
Un saludo,
Carmen
QuimiTube, 12 Años Antes
alguien me puede decir de donde proviene el termino oxidacion porfavooor!!!!!!!!!!!!!!!!!!!!
:), 12 Años Antes
¡Hola! En el vídeo se explica con detenimiento, te sugiero que lo veas. Un saludo.
QuimiTube, 12 Años Antes
Te felicito y agradezco por la gran ayuda de tus videos!!! Realmente entiendo mucho más con las clases de la uni, es verdad eso que dicen de que hay que saber enseñar para ser profesor! =)
Me ayudaste mucho con Buffer y Redox, que son los temas que más cuesta que entren en mi cabeza, MUCHAS GRACIAS y sigue adelante!!! Saludos desde Argentina! =)
Noelia, 11 Años Antes
Muchísimas gracias Noelia por tomarte tu tiempo para dejar este comentario alentador 🙂 Me alegro mucho de que te hayan servido y espero que te sigan sirviendo. Un saludo grnade.
QuimiTube, 11 Años Antes
YO NECESITO LA EXPLICACION NO VIDEOOOOOOOOOOOOO LOCOS
LAURAVALENTINA, 11 Años Antes
¡Hola! En quimitube nos dedicamos esencialmente a los vídeos, aunque es cierto que la explicación por escrito está también en muchos de nuestros materiales, aunque no en este. De todos modos en la red encontrarás la explicación en muchos sitios, pero te recomiendo que veas el vídeo, está realmente muy bien explicado y lo entenderás todo, seguramente antes que leyendo por tu cuenta porque es como ir a clase. Un saludo.
QuimiTube, 11 Años Antes
Hola Licenciada!, he tenido una duda con respecto a los diferentes tipos de reacciones en redox, una en especial es el de desproporcion y combinación, la verdad no logro distinguir entre uno y otro, para mi son identicas.
porque ejemplo en la formación de agua oxigenada
H2O+H2—-H2O2, para mi esta rx seria de combinacion y no de desporporción pero mucho libros dicen que es de desproporcion alguna manera de identificar estas dos tipos de rx? Gracias y saludos!
Roberto, 11 Años Antes
me encanto tu explicacion es muy sencillay clara. ahora necesito saber, como se proveen los iones que neutralizan los radicales libres en el agua pi. o como se comporta el agua pi en estos procesos de redox? gracias por tu repuesta debo hacer una presentacion mañana a cerca de este tema y necesioyo que sea lo mas sencillo posible. reaxion redox en el agua pi. gracias por tu oportuna colaboracion
maria clara latorre, 11 Años Antes
¡Hola Maria Clara! Gracias por tu comentario. Me encantaría ayudarte, pero la verdad es que no sé qué es el agua pi, ¿sabes algún otro nombre con el que se conozca esto? Tal vez lo llamamos de formas distintas…
QuimiTube, 11 Años Antes
hola, soy de Perú .Desde que encontré los vídeos en el youtube los vi y me encantaron me ayudan mucho en la universidad . Quiero agradecer su esfuerzo por colgar los vídeos en la red y por explicar tan bien toda la teoría estoy infinitamente agradecida !!!
katty galarreta, 11 Años Antes
¡Hola! Me alegra mucho que descubrieras los vídeos y que te estén ayudando con tus estudios. Mucho ánimo, a veces es duro pero estudiar vale mucho la pena. Un saludo muy grande hasta Perú y gracias por dejar este comentario.
QuimiTube, 11 Años Antes
Hola!!! Este año he empezado la universidad con 28 años y estoy un poco perdido con el tema de volver a estudiar. Sinceramente con esta página tengo un extra que me ayuda mucho a entender la materia, ya que la claridad con la que explicas es de admirar.
Muchas gracias por el trabajo, personalmente me sirve de mucha ayuda.
Héctor, 11 Años Antes
Muchas gracias Héctor, y mucha suerte con retomar tus estudios. Es duro volver a estudiar después de un tiempo, pero también creo que es muy gratificante. Un saludo grande.
QuimiTube, 11 Años Antes
Muchas gracias por tus vídeos! Me han salvado de un cero! Jajaja 🙂 Hacen un gran aporte y un trabajo genial! Bendiciones!
Alejandra, 11 Años Antes
QuimiTube, tengo una gran duda y espero que me la puedan resolver, ¿cómo puedo diferenciar una ecuación redox de una ácido-base? Gracias y saludos 😀
Valentina Erazo, 11 Años Antes
Hola Valentina. En una reacción ácido-base solo intervienen dos elementos o reactivos, el ácido y la base, que reaccionan entre sí para neutralizarse o bien para intercambiar un protón. Si tienes claros algunos ácidos y bases comunes, no tendrás problemas en ver que la reacción de neutralización es ácido + base = sal + agua, o también puedes tener una reacción del tipo HA + H2O = A- + H3O+, en la que el agua actúa como base, o B + H2O = BH+ + OH-, en la que el agua actúa como ácido. Además, si así no te es suficiente, puedes distinguirlas porque en la reacción ácido-base no hay cambios en los estados de oxidación de los elementos que intervienen. Si hay cambios en los estados de oxidación, será siempre una reacción redox.
QuimiTube, 11 Años Antes
Antes que nada, te felicito por la iniciativa y el esfuerzo, la teoría que pones en cada video bastante clara, y como decía mi profesora de residencia, muy buen ritmo docente el tuyo.. 🙂 saludos y en lo que te pueda ayudar conta conmigo..
jorge, 11 Años Antes
Muchísimas gracias Jorge, tu comentario me anima mucho a continuar con esta labora; me alegra que te sirva y que te parezca un buen ritmo docente. Un abrazo.
QuimiTube, 11 Años Antes
Hola Carmen! te pongo esta pregunta aqui porque no se en que otro lugar ponderla.
Bueno el Mn tiene muchas valencias y me confunde mucho y no se cuando usarlas y siempre me equivoco cuando formulo con el Mn. Podrias decirme las valencias correctas? mucha gente usa diferentes valencias. Pero creo que debe algun tipo de regla sobre este elemento que nos permita identificar rapdamente cuales son las valencias que tenemos que utilizar.
Please ayuda
Gracias como siempre
😉
Sachet, 11 Años Antes
Hola. Gracias por hacer comprensibles estos temas.
Tengo 49 y la química fue el coco en mi bachillerato y le universidad. ( Soy ingeniero industrial ).
Hoy estoy repasando estos temas y realmente entendiéndolos con tu ayuda. Y lo hago por que mi hijo menor esta por seguir los mismos pasos míos, de pasar por la química básica sin entenderla, y no quiero que sea asi, por eso la estoy estudiando con el.
Un saludo
Juan Manuel Garces. Cali ( Colombia )
Juan Manuel Garces G, 11 Años Antes
Hola Juan Manuel, cuánto agradezco tu comentario. Es una pena pasar por una asignatura sin comprenderla, al final yo creo que es tiempo perdido, así que agradezco el esfuerzo que haces para que tu hijo aprenda la materia en lugar de meramente aprobarla, es muy bonito. Gracias de nuevo y un abrazo.
QuimiTube, 11 Años Antes
Muchas gracias por tus videos y explicaciones, me estan ayudando mucho. Porque en clase la profesora no explica nada y lo que explica no se entiende y gracias a ti estoy entendiendo todo porque iba muy mal en quimica y lo estaba pasando muy mal, hacia todo los ejercicios y luego el examen fatal. Muchas gracias enserio!
miri, 11 Años Antes
¡Muchas gracias Miri! Me alegra mucho que te sirvan tanto, es una pena que los alumnos pasen por la asignatura de química con angustia y no como una asignatura interesante que vale la pena aprender. Un saludo.
QuimiTube, 11 Años Antes
Jesucristo con tus vídeos he visto la luz. Bendecida seas. Aseguro que gracias a ti la química me parece por primera vez entendible. Se agradece que haya gente que explique la química así, ¡que no todos somos catedráticos licenciados!
Yosua, 9 Años Antes
Muchas gracias Yosua, me alegra que te sirvan los contenidos 🙂 Un saludo grande
QuimiTube, 9 Años Antes
Buena explicación de los procesos REDOX
Os dejo un enlace a mi blog en el que hablo del mismo tema http://descubrirlaquimica2.blogspot.com.es/p/introduccion-las-reacciones-redox.html
Descubrirlaquimica2, 9 Años Antes
¡Genial! Gracias por compartir la info. Un saludo grande.
QuimiTube, 9 Años Antes
hola…. buenisimo el video, no es facil encontrar videos tan claros en quimica.
tengo una duda sobre los procesos de redox,
en un experimento con conductores por un lado cobre por otro zinc , actuan perfectamente conduciendo energia, pero al conectarlos a agua destilada no lleva energia, a que se debe ?
fabiola, 9 Años Antes
¡Hola Fabiola! Disculpa la tardanza en mi respuesta. Entiendo que te refieres a que no conducen la electricidad cuando están en agua destilada… El agua destilada tiene una concentración de iones muy pequeña y por ello no es conductora. Solemos decir que el agua es conductora cuando no es así, lo es el agua del grifo porque tiene gran cantidad de iones en disolución y son estos los que conducen la electricidad, pero no el agua por sí misma. Un saludo grande.
QuimiTube, 8 Años Antes
No he encontrado todavìa sitio mejor para revisar los temas de quimica, muy buen trabajo¡
gonzalo, 9 Años Antes
Muchísimas gracias Gonzalo, me alegra que te guste y te sirva. Un saludo.
QuimiTube, 9 Años Antes
ante todo felicitaciones por tus videos , me ayudaron mucho , he pensado en hacer mi proyecto de investigacion sobre este tema , pero no se muy bien mas o menos cual , tengo muchas ideas tales como infusiones de te pero no se como darle una orientacion a este tema 🙁
disculpa por la molestia espero respondas:(
luana, 9 Años Antes
¡Hola Luana! ¿Te refieres a un proyecto relacionado con reacciones redox? Hay muchas cosas interesantes, como por ejemplo esto:
http://www.quimitube.com/fabricacion-de-hipoclorito-sodico-lejia-casera-con-una-pila-y-agua-con-sal
http://www.quimitube.com/fabricacion-de-una-pila-daniell-con-un-limon
Espero que te sirvan, si estás pensando algo distinto o más sencillo me dices. ¿A qué te refieres con lo de las infusiones? Un saludo.
QuimiTube, 9 Años Antes
Muchas gracias por tus explicaciones, estaría perdida sin ellas!! gracias a ellas espero aprobar la prueba de acceso!
Felicidades por el gran trabajo!!
Sònia Font, 9 Años Antes
¡Hola! Disculpa la tardanza, espero que te fuese muy bien! Un abrazo.
QuimiTube, 8 Años Antes
Hola!!! Lo primero me encanta tu página y me está siendo muy muy útil, soy otra más que va a aprobar química gracias a ti !!! Si pudieras hacerme una aclaración te lo agradecería porque me cuesta mucho el concepto de oxidante y reductor. En el minuto 7:48 (más o menos, un poco antes) estás hablando del Cobre que es un oxidante. He llegado a esta conclusión y no sé si lo estoy entendiendo bien.
Mientras que el Cobre (Cuº) está captando electrones, es decir los está ganando, el Cu2+ los está perdiendo y por tanto se está comportando como un oxidante. Es correcto?
Rocio, 8 Años Antes
¡Hola Rocío! ¡Muchas gracias y disculpa la tardanza en mi respuesta! El cobre metálico es reductor, no oxidante, porque puede ceder electrones para pasar a Cu2+, pero no puede captarlos (quedaría como un anión, lo cual no ocurre en un metal). Por su parte, el Cu2+ es un oxidante (eso sí lo has puesto bien) porque puede captar electrones para pasar a Cu0.
QuimiTube, 8 Años Antes
[…] Las reacciones de oxidación-reducción (también llamadas reacciones redox o reacciones de transferencia de electrones), reciben este nombre porque al principio los químicos clasificaron dentro de este tipo únicamente la reacción de ciertas sustancias con el oxígeno. Por ejemplo, la reacción del hierro con el oxígeno: […]
Reacciones redox – El caos de Alicia, 5 Años Antes
me sirvio mucho muchas gracias esta muy bien
lilith, 4 Años Antes
Muchas gracias Lilith y bienvenida.
QuimiTube, 4 Años Antes
En el proceso de reducción la especie que se reduce gana átomos de oxígeno o gana átomos de hidrógeno?
Gracias
Emily, 4 Años Antes
Hola Emily, puede haber casos concretos en los que la especie que se oxida o se reduce gane oxígeno o hidrógeno respectivamente, pero como verás en el vídeo consideramos un concepto de oxidación reducción más genérico, que es la pérdida o la ganancia de electrones.
QuimiTube, 4 Años Antes