Contenido del Vídeo
Ya hemos descrito las estructuras de Lewis de algunas moléculas covalentes sencillas. Sin embargo, dichas estructuras de Lewis, aunque nos aportan información de cómo se enlazan los átomos, no nos aportan información de la distribución espacial de estos enlaces en el espacio, es decir, la geometría molecular. Así, por ejemplo, en vistas de la estructura de Lewis del amoníaco:
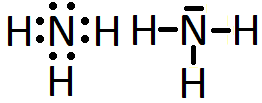
resulta imposible discernir si su geometría es trigonal plana, o de pirámide trigonal, o con enlaces que formen 90º entre sí… Es por este motivo que, para predecir la geometría de las moléculas covalentes, hacemos uso de dos modelos: el modelo del enlace de valencia, dentro del cual consideraremos la hibridación de orbitales atómicos, y el modelo de repulsión de los pares electrónicos de la capa de valencia, abreviado con las siglas RPECV.
Este último, a pesar de la aparatosidad del nombre, es el más sencillo y el que vamos a explicar en este vídeo. El modelo de repulsión de los pares electrónicos de la capa de valencia parte de una idea intuitiva y sencilla: dado que los electrones son cargas negativas y se repelen entre sí, la geometría de la especie química considerada será aquella que permita minimizar las repulsiones entre los pares electrónicos que se hallan en torno al átomo central, es decir, los electrones de la capa de valencia del átomo central. Estos pares electrónicos pueden ser tanto pares pertenecientes a un enlace químico con otro átomo (pares enlazantes) como pares libres (pares no enlazantes). Así, estos pares electrónicos en torno al átomo central se colocarán lo más separados posible para que la repulsión entre ellos sea mínima.
Cabe destacar, no obstante, que los pares no enlazantes causan mayores repulsiones a lo pares vecinos que los pares enlazantes, motivo por el cual algunas moléculas con pares libres en torno al átomo central, como el amoniaco o el agua, presentan ligeras variaciones en el ángulo de enlace esperado. Puesto que nos basamos en la capa de valencia del átomo central, el modelo RPECV es útil únicamente para la predicción de la geometría de moléculas covalentes sencillas, formadas por un átomo central enlazado a algunos átomos periféricos.
En función del número de pares de electrones (enlazantes o no enlazantes) en torno al átomo central, estos pares se dispondrán de la forma siguiente:
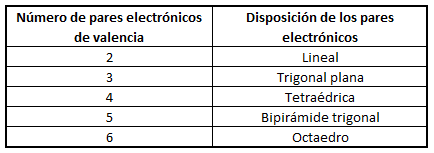
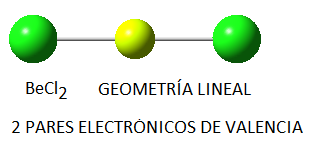
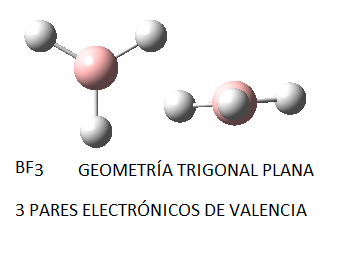
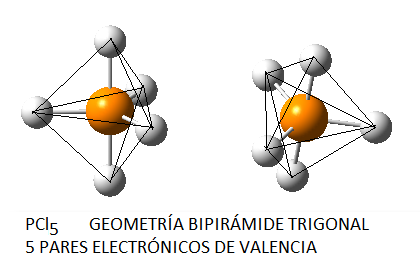
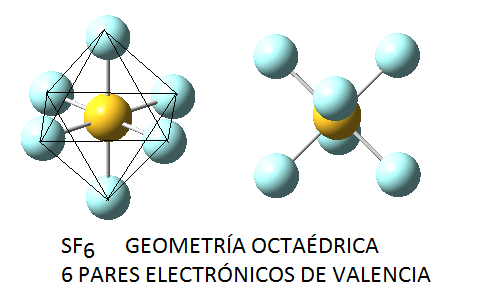
No obstante, si las moléculas presentan pares libres, lo cual sucede principalmente (al menos en los ejemplos que consideraremos) en moléculas cuyo átomo central tiene 4 pares electrónicos, la disposición no coincide con la geometría molecular final. Así, el amoníaco, NH3, en el cual el nitrógeno tiene 4 pares de electrones de valencia, uno no enlazante y tres enlazantes, tendrá geometría de pirámide trigonal, a pesar de que los pares electrónicos se dispondrán de forma tetraédrica por ser 4; del mismo modo, en el caso del agua, el oxígeno tendrá en torno a sí 4 pares electrónicos, 2 enlazantes y 2 no enlazantes, que se dispondrán tetraédricamente, pero la geometría final de la molécula de agua será angular. Así, en la siguiente tabla se puede ver la geometría correspondiente para algunas moléculas con 4 pares electrónicos en torno al átomo central, en función de la relación existente entre pares enlazantes y pares no enlazantes:
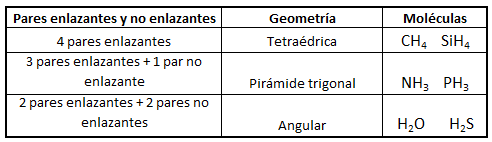
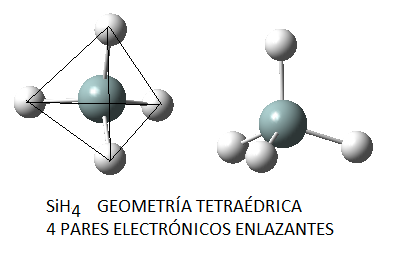
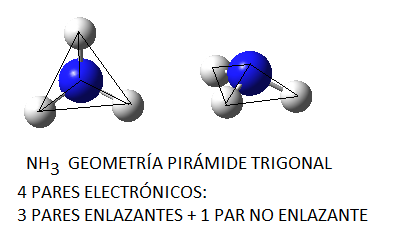
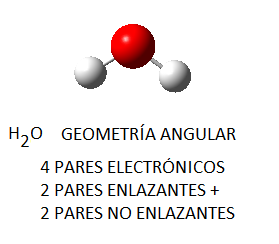
Nota: las imágenes moleculares aquí representadas han sido realizadas haciendo uso del programa Gauss View 5.0
Category: Enlace Químico y Teoría de Enlace Químico.
Etiquetas: Enlace covalente y Geometría molecular e hibridación.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Información Bitacoras.com…
Valora en Bitacoras.com: Ya hemos descrito las estructuras de Lewis de algunas moléculas covalentes sencillas. Sin embargo, dichas estructuras de Lewis, aunque nos aportan información de cómo se enlazan los átomos, no nos aportan información de la di…..
Bitacoras.com, 12 Años Antes
Hola!
Tengo una duda 🙁
Como seria la geometria y enlace de lewis de NO2?
Si los enlazo con enlaces simples lles sobra 3 e-, si los enlazo con enlaces dobles me queda 1e- libre. Como se representaria ese electron libre?
Muchas gracias!
dg, 12 Años Antes
Sí, en efecto es un poco más complicada que otras y, como bien has puesto, te queda un electrón libre. Además la otra duda que planteas, la de dónde colocar el electrón libre, también es lógica, precisamente porque puedes colocarlo sobre el nitrógeno o sobre el oxígeno. De hecho la estructura real no será ni la una ni la otra sino una intermedia, por lo que debemos plantear formas resonantes, como verás aquí:
http://en.wikipedia.org/wiki/File:NO2-Schema-Lewis.png
Cabe destacar que yo añadiría otra forma resonante más, y es la misma que la primera pero con el doble enlace nitrógeno-oxígeno en el otro oxígeno, en el primero.
Un saludo 😀
Quimitube, 12 Años Antes
uff! muchisimas gracias!
dg, 12 Años Antes
¿Como se llamaría con 2 pares enlazados y uno no enlazado?
wilfred, 12 Años Antes
Hola Wilfred, bienvenido 🙂
Si tuvieses una molécula cuyo átomo central tiene 3 pares electrónicos, estos pares se colocarían en los vértices de un triángulo equilátero. Pero como uno de ellos sería un par libre y no se tiene en cuenta a la hora de definir la geometría molecular, entonces sería geometría angular, es decir, algo así <
QuimiTube, 12 Años Antes
Gracias!
wilfred, 12 Años Antes
De nada 🙂
QuimiTube, 12 Años Antes
Muchisimas gracias, me ha servido de gran ayuda este video ya que andaba estresada con que no entendía nada. Se entiende fenomenal, muchas gracias de nuevo.
Un saludo.
Clara Martínez, 12 Años Antes
Hola Clara, me alegro mucho de que te haya servido y de que estés un poco menos estresada 🙂 Si aún tienes dudas pregunta. Un saludo grande.
QuimiTube, 12 Años Antes
Una pregunta, por ejemplo con el propano o el etano, que geometría tendrían?
Gracias, un saludo.
Teresa, 12 Años Antes
Hola Teresa, en el caso del propano y el etano, como se trata de alcanos en los cuales todos los átomos de carbono formarán enlaces simples, tendrás hibridación sp3 como en el metano. Es decir, cada átomo de carbono presentará 4 orbitales híbridos sp3 orientados hacia los vértices de un tetraedro. Échale un vistazo a este vídeo donde aparece la geometría del etano (también la hallarás en la explicación escrita del vídeo, al pie):
http://www.quimitube.com/videos/modelo-del-enlace-de-valencia-hibridacion-sp3-del-metano-y-el-etano/
Un saludo,
Carmen
QuimiTube, 12 Años Antes
Hola que tal, me alegro de que cuelgues este tipo de videos, muchas gracias.
En lo que respecta a la estructura de Lewis del NO2 en la que pones un link de wikipedia, no me salen las cuentas ya que en la primera el oxígeno tiene carga efectiva positiva y en la segunda hay cuatro pares de electrones enlazantes cuando en el cálculo algebraico de electrones nos salen 3 pares enlazantes, ¿cómo es posible?
Gracias denuevo
Gonzalo, 11 Años Antes
He de decir que no estudié química en 2º de bach. pero que la he tenido que «soportar» en el primer curso de universidad. Pero gracias a algunos de estos vídeos (rédox, ácidos-bases, estructura atómica y enlaces) he conseguido sacar (en la recuperación) un 7.25. =). Lo mejor ( o peor según lo mires) es que has sido más útil que mi profesor.
Y también añadir que la química ha sido una asignatura que he detestado bastante a lo largo del instituto pero la verdad es que tú la haces muy agradable y fácil. Sigue así.
Un saludo. Y gracias.
Miriam, 11 Años Antes
¡Hola Miriam! Qué bien, un 7,25 es una notaza 🙂 Me entristece un poco que tu relación con la química haya sido mala hasta el momento, y me alegro de que al menos ahora haya mejorado un poquito, con que no la recuerdes con angustia o con tedio me conformo jeje. Gracias por dejar aquí este comentario, me da ánimos para continuar. Un abrazo.
QuimiTube, 11 Años Antes
Aunque ya te haya agradecido alguna vez tu trabajo,cuando vuelves a entender otra cosa sin siquiera ver el vídeo,sólo leyendo con atención el texto y con los gráficos,(que supongo,también requiere su tiempo encontrar los adecuados)no está de más invertir un minuto en agradecer el trabajo que haces. Gracias.
sara, 11 Años Antes
Gracias de nuevo, Sara, siempre es agradable recibir un comentario de los alumnos que encuentran utilidad en los contenidos. Hacer los gráficos lleva su tiempo pero es entretenido 🙂 Un abrazo grande.
QuimiTube, 11 Años Antes
Muy buena explicación, excelente material. 🙂
abraham, 10 Años Antes
De verdad que tienes un talento incrible, te haces entender super bien no se como sabes tanta quimica la verdad la quimica para mi es horrible pero ayudas mucho gracias 😀
Alejandra, 10 Años Antes
Jajaja, espero que al final no te parezca tan horrible, si es muy bonita 🙂 Me alegra mucho que te sirva, ánimo con tus estudios. ¡Un abrazo!
QuimiTube, 10 Años Antes
Hola! xD
He venido a agradecer la labor que haces justo en este video porque esta fue una de las dos preguntas de teoría que me entraron en la PAU. Para mi la teoría me parecía un autentico horror y gracias a estos videos no solo la entendí sino que obtuve las herramientas para poder responder, razonar y justificar mi respuesta.
El examen consta de 3 problemas (6 puntos máximo) y 2 preguntas de teoría (4 puntos máximo)… El año pasado tuve un 5.35, no estudié la teoría por lo que comentaba, que me parecía horrible y una verdadera perdida de tiempo. Este año que me presenté a subir nota necesitaba estudiar la teoría y gracias a tus videos entendí la teoría y obtuve las herramientas necesarias para poder razonar y justificar lo entendido. Pues bueno, he sacado un 9,3!!! Mil gracias, de verdad!!
Trabajando es complicado dedicarle todo el tiempo que uno quiere al estudio y a parte muchas veces faltan las ganas de estar estudiando tochos de cosas que no entiendes, pero tu (con permiso del tuteo xD) me lo pusiste súper fácil, no he dudado en recomendarte! Y en la biblioteca donde estudiaba la gente muchas veces se quedaba mirando porque me veian durante horas viendo videos jajaj, en fin! Espero este año obtener la plaza en enfermería! Te estaré eternamente agradecida 🙂
Mandy, 10 Años Antes
GENIALES TUS VÍDEOS Carmen !!!!! Estoy muy motivada a subir nota en Selectividad para la convocatoria de junio de 2015! Explicas excelentemente bien!..y FELICIDADES por todo tu trabajo realizado que hace que aprendamos y entendamos con mayor facilidad esta ciencia! Ojalá te hubiéramos tenido muchos de nosotros como profesora de Química jejej =) Un besito.
Vanessa, 10 Años Antes
¡Hola Vanessa! Como tengo algunos problemas con los comentarios en la web (¡espero solucionarlo pronto!) acabo de ver tu comentario 😀 Ya veo que es de junio pero me anima igual, ¡me hace mucha ilusión! ¿Qué tal llevas la preparación? Espero que fenomenal. Un abrazo.
QuimiTube, 10 Años Antes
Muchas gracias por los videos, mi profesora no se explica del todo bien y siempre saco más de 9 gracias a tus videos. Sinceramente no sé que haría sin estos recursos, además de que me quitan el miedo a selectividad.
Un abrazo 😀
LS, 10 Años Antes
¡Hola! Muchas gracias por tu comentario y enhorabuena por tus notas 🙂 ¡Son fenomenales! Efectivamente no hay que tener miedo a selectividad, si haces muchos ejercicios entendiendo el porqué de las cosas, verás que selectividad solo es un examen más, tan igual a los que has hecho el resto del curso que cuando acabas piensas: «¿Y para esto tantos nervios?». Un saludo y ánimo.
QuimiTube, 10 Años Antes
Hola! Una duda! Vi tu video de TEV con TRPECV, y tengo duda de por qué multiplicas por 8 a distintos elementos, y al H solo por 2? Cuando lo hago con el BCl3, me queda:
(3)+(7*3)=24e
(8*4)=32e
32e-24e=8e=4 pares enlazados
24e-8e=16e=8 pares no enlazados
🙁 ayuda!
Ate, 10 Años Antes
¡Hola! La mayoría de átomos de las moléculas que se tratan a nivel educativo necesitan 8 electrones para tener completa su última capa, sobretodo los del nivel 2 de la tabla periódica (por ejemplo nitrógeno, carbono u oxígeno). Por esto consideramos 8 electrones para ellos. El hidrógeno, en cambio, como su configuración electrónica es 1s1, solo necesita dos electrones para tener la última capa completa, y alcanzar una configuración electrónica de gas noble, la del helio, 1s2. Por eso para el hidrógeno consideras siempre 2 electrones. Sin embargo, en el ejemplo que indicas, BCl3, el boro es uno de los elementos que pueden presentar excepción a la regla del octeto por defecto. Lo tienes aquí para entenderlo mejor:
http://www.quimitube.com/videos/enlace-covalente-excepciones-a-la-regla-del-octeto
Espero que te sirva. Un saludo grande.
QuimiTube, 10 Años Antes
Hola pues, tengo una duda, en la facultad me pide identificar geometria molecular y electronica, y no se como detectar la electronica.
Mariana, 10 Años Antes
Hola Mariana, creo que con la geometría electrónica se refiere simplemente a la distribución de los electrones en torno a los distintos átomos, es decir, indicar el diagrama de Lewis que necesitas para predecir posteriormente la geometría.
Aquí tienes material:
http://www.quimitube.com/videostags/estructuras-de-lewis
Un saludo grande
QuimiTube, 10 Años Antes
Buenas tardes!! Hace poco descubrí tus videos y la verdad es que me has ayudado muchisimo. Y viendo este video tengo una duda, si el berilio es un metal y el cloro es un no metal por que forman un enlace covalente? Yo pensaba que formaban un enlace ionico. Y todas las moleculas se pueden representar con lewis, independientemente del enlace que las una? Muchas gracias, un saludo
Natalia, 9 Años Antes
¡Hola! Me alegra que te sirvan los vídeos. Las estructuras de Lewis son únicamente para enlaces covalentes, pero en el BeCl2 tu duda es lícita. Por ello hicimos esta entrada de blog para profundizar en esta controversia, espero que te sirva:
http://www.quimitube.com/el-enlace-del-cloruro-de-berilio-es-covalente-o-ionico
Un saludo.
QuimiTube, 9 Años Antes
Muchisimas gracias, está perfectamente explicado, has aclarado todas mis dudas. Gracias por hacer todos estos videos.
Un abrazo grande
Natalia, 9 Años Antes
Hola disculpa como seria la geometría de moléculas que solo tienen un electrón libre? No un par
david, 9 Años Antes
El electrón libre también ejercerá repulsión y contará como un par libre, aunque su repulsión será menor que el par completo y esto variará los ángulos de apertura.
QuimiTube, 9 Años Antes
Muy buena explicación
Gracias por una explicación tan clara
Saludos desde Ecuador
Paul, 9 Años Antes
Gracias a ti por comentar, un saludo.
QuimiTube, 8 Años Antes
De verdad que has sido mi salvación en este curso, no he bajado del 9 y me da la nota para medicina gracias a ti, eres de lo mejor que he visto por youtube, muchísimas gracias !!
Encantada ♥, 7 Años Antes
¡Muchas gracias con mucho retraso! Es curioso, me escribiste este bonito comentario el día de mi cumpleaños 🙂 ¡Un abrazo!
QuimiTube, 7 Años Antes