Contenido del Vídeo
Ya hemos visto que existen un tipo de sustancias covalentes que son de naturaleza molecular, es decir, que están formadas por moléculas independientes unidas entre sí por fuerzas débiles. Estas fuerzas débiles se denominan fuerzas intermoleculares y existen, incluso, entre átomos individuales que no forman enlace, como es el caso de los gases nobles.
Consideremos la energía de las fuerzas intramoleculares (dentro de la propia molécula, enlace covalente) e intermoleculares (entre distintas moléculas) del cloruro de hidrógeno, HCl, y del hidrógeno, H2.
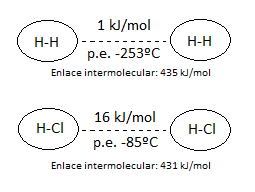
Cuanto más intensa es la fuerza intermolecular que une las moléculas mayor será el punto de fusión y ebullición, porque son éstas las fuerzas que debemos vencer para separarlas. En efecto, como vemos en los dos casos anteriores, el HCl, que forma fuerzas intermoleculares mucho más intensas, tiene un punto de ebullición 167ºC más elevado que el del hidrógeno.
Así pues, las moléculas covalentes pueden unirse entre sí mediante fuerzas intermoleculares, pero estas últimas no siempre tienen la misma intensidad. ¿De qué depende la mayor o menor intensidad de las fuerzas intermoleculares? Esencialmente, de la polaridad de la molécula. Es en base a este criterio, el de la polaridad, que estableceremos una clasificación de las fuerzas intermoleculares. Así, tendremos:
- Fuerzas intermoleculares entre moléculas apolares. Reciben el nombre de fuerzas dipolo instantáneo – dipolo inducido, o también fuerzas de dispersión o fuerzas de London. En este caso, la mayor intensidad de este tipo de fuerzas dependerá de la masa. A mayor masa molecular, mayores fuerzas de dispersión y, por tanto, mayores puntos de fusión y de ebullición. No obstante, en general son fuerzas de carácter muy débil, como veremos en un próximo apartado; de hecho son las más débiles de todas las fuerzas intermoleculares.
- Fuerzas intermoleculares entre moléculas polares. En este caso tenemos dos tipos:
- Fuerzas dipolo – dipolo o fuerzas de Van der Waals. Se trata de fuerzas entre dipolos permanentes (por diferencia de electronegatividad entre los átomos en moléculas cuyos dipolos no se anulan por geometría).
- Enlaces de hidrógeno. Se presenta cuando la molécula tiene enlaces formados por un átomo de hidrógeno y un átomo pequeño y muy electronegativo, como flúor, nitrógeno u oxígeno.
Category: Enlace Químico y Teoría de Enlace Químico.
Etiquetas: Enlace covalente y Fuerzas intermoleculares.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Gracias! 🙂
dag, 12 Años Antes
De nada y bienvenid@ 🙂
QuimiTube, 12 Años Antes
El puente de hidrógeno influye en el punto de ebullición? Cómo?
Maira, 4 Años Antes
¡Hola! Te recomiendo que veas este vídeo o te leas la explicación escrita, ahí lo tendrás. https://www.quimitube.com/videos/enlaces-de-hidrogeno-y-fuerzas-de-van-der-waals/
QuimiTube, 4 Años Antes
Hola, me gustaría saber cómo calcular la polaridad de una molécula. Es decir, sé que tiene
Laura, 11 Años Antes
¡Hola! Podrías calcularla considerando los vectores momento dipolar y haciendo suma matemática de vectores por componentes.
QuimiTube, 11 Años Antes
Hola , quisiera saber cual es la relación que existe entre las fuerzas intermoleculares,peso molecular y punto de ebullición
Patricia, 11 Años Antes
Quisiera saber si el estado de la materia puede encontrar una moelcula, depende de la fuerza intermolecular? Y tambien como determino el menor y mayor punto de ebullicion
Camila Carvajal, 11 Años Antes
Sí, la fuerzas intermoleculares son las responsables del mayor o menor punto de fusión y de ebullición de las sustancias covalentes moleculares. Te recomiendo que veas los siguientes vídeos de fuerzas intermoleculares:
http://www.quimitube.com/videostags/fuerzas-intermoleculares/
Ahí verás tanto los vídeos teóricos que te faltan por ver como ejercicios en los que ordenamos por punto de ebullición y fusión.
Un saludo.
QuimiTube, 11 Años Antes
excelente explicación te entiendo ati en menos de nada que mi profesora de universidad .
sebastian, 10 Años Antes
Hola Sebastián, muchas gracias, me alegra que te sirva. Un saludo.
QuimiTube, 10 Años Antes
excelente tu explicacion la verdad entendi casi todo de este tema pero todavia tengo una duda, la definicion de dipolo permanente seria simplemente la siguiente : una molecula covalente polar que no se anule por geometria?? o hay otra definicion ?
gracias
stefany, 9 Años Antes
¡Hola! Así estaría bien definido, esa molécula que indicas sería un dipolo permanente, como ocurre con la molécula de agua. Un saludo.
QuimiTube, 9 Años Antes
Hola, en primer lugar darte la enhorabuena por tus videos tan didácticos, ayudan muchísimo. Me gustaría consultarte la siguiente duda: ¿las moléculas des CH4 al ser apolares se unen mediante fuerzas de dispersión o de London o mediante fuerzas de Van der Waals (te lo pregunto porque en la respuesta de un examen de selectividad se afirma que es mediante fuerzas de Van der Waals y me está dando lugar a dudas)
Gracias de antemano
Javier, 9 Años Antes
Hola Javier, en algunas ocasiones (lo he visto en ciertos libros) consideran las fuerzas de London como un tipo específico de fuerzas de Van der Waals, de ahí, imagino, que te lo pusiera de este modo. Sin embargo a mí esto no me parece correcto, las fuerzas de Van der Waals se dan entre moléculas polares y el metano es claramente apolar, yo pondría fuerzas de dispersión y lo justificaría convenientemente, no te lo pueden poner mal, al contrario. Un saludo y gracias por tu comentario.
QuimiTube, 9 Años Antes
AGRADECIDA CON TODOS TUS VIDEOS, EXCELENTE…
VERO, 8 Años Antes
¡Muchas gracias!
QuimiTube, 8 Años Antes
Gracias por los vídeos me ayudó mucho a entender la materia!!
Anabel, 8 Años Antes
Me alegra mucho Anabel, bienvenida.
QuimiTube, 8 Años Antes
Muy buen video
Diego Alexander, 8 Años Antes
Por fin una buena explicación.Muchas gracias
Pilar, 7 Años Antes