Contenido del Vídeo
Para el caso de la hibridación sp2 sin formación de enlaces múltiples, vamos a considerar como ejemplo la molécula de trifluoruro de boro, BF3 (gas incoloro tóxico). La explicación de la hibridación sp2 para esta molécula es también aplicable a moléculas análogas, como el trihidruro de boro, BH3 (borano, compuesto de existencia muy fugaz por su alta reactividad) o el tricloruro de boro, BCl3.
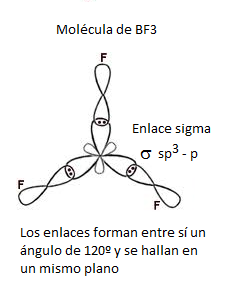
Ya hemos predicho a partir del Modelo de repulsión de pares electrónicos de la capa de valencia, RPECV, que el BF3 tiene una geometría trigonal plana, es decir, que los 3 enlaces B-F se hallan en el mismo plano, formando entre sí ángulos de 120º. Esta geometría molecular para el trifluoruro de boro coincide con la determinada experimentalmente. Además, según estos datos experimentales, se sabe que los tres enlaces B-F son idénticos (distancia de enlace, energía de enlace).
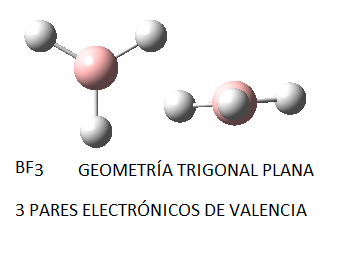
Por tanto, aunque se puede predecir de forma sencilla la geometría molecular a partir del modelo RPECV, un estudio más profundo del enlace químico requiere considerar la promoción de un electrón así como la hibridación de orbitales atómicos.
Veamos por qué.
En primer lugar, consideremos la configuración electrónica del boro, que tiene un número atómico Z = 5, es decir, 5 electrones. Así:
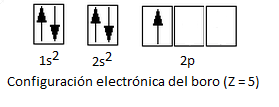
Como vemos, el boro tiene únicamente un electrón desapareado en el orbital 2p. Según esto, únicamente podría formar un enlace covalente, ya que el Modelo del Enlace de Valencia establece que los orbitales atómicos deben estar semillenos (un único electrón) para poder solapar con los orbitales atómicos de los otros átomos y formar el enlace covalente.
Entonces, ¿cómo es posible que el boro forme 3 enlaces covalentes? Para explicar por qué el boro forma tres enlaces covalentes, debemos admitir la promoción de un electrón desde el orbital 2s a un orbital 2p vacío; pasará, por tanto, de un estado fundamental a un estado excitado, según vemos:
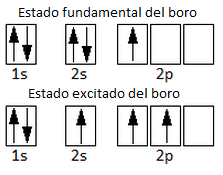
Aunque esta promoción del electrón desde el orbital 2s a un 2p vacío requiere un aporte de energía adicional, se verá compensado por la posterior formación de 3 enlaces boro-flúor en lugar de un único enlace, que es el que podría formar el boro en estado fundamental.
Una vez considerada la promoción del electrón, podemos justificar la formación de 3 enlaces, pero no el hecho de que estos sean exactamente iguales. No obstante, es un hecho experimental que los 3 enlaces covalentes boro-flúor son idénticos. Para justificar esto, se recurre al concepto de hibridación de orbitales atómicos. Así, los tres orbitales atómicos semiocupados, el s y los 2 orbitales p, se hibridan o combinan entre sí para dar 3 orbitales híbridos sp2, equivalentes entre sí en forma y en energía.
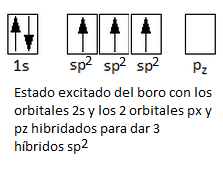
Cada híbrido sp2 tendrá un electrón desapareado con el que podrá formar un enlace covalente por solapamiento con un orbital p del flúor. Los 3 híbridos sp2 se dirigen siempre a los vértices de un hipotético triángulo equilátero. Se hallen en un mismo plano, formando entre ellos un ángulo de 120º.
La forma aproximada de un orbital híbrido sp2 será de dos lóbulos desiguales:

Puesto que un orbital híbrido sp2 tendrá una contribución de 1/3 de orbital s, decimos que tiene un 33% de carácter s, y una contribución de 2/3 de orbitales p, decimos que tiene un 66% de carácter p.
Finalmente, el lóbulo mayor de cada híbrido sp2 solapa frontalmente (en el mismo eje del enlace, se trata, por tanto, de un enlace simple de tipo sigma, σ) con el orbital 2p semilleno de un átomo de flúor, dando lugar a un enlace σ(sp2-p).
Category: Enlace Químico y Teoría de Enlace Químico.
Etiquetas: Enlace covalente y Geometría molecular e hibridación.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
|Hola! Pienso que la ultima imagen tiene un error, es un enlace sigma sp2-p y no sp3-p. 😉
Soraia, 11 Años Antes
¡Hola! Tienes toda la razón, en cuanto tenga ocasión lo cambio. Gracias por el aviso 🙂
QuimiTube, 11 Años Antes
Por mi no hay problema pués en el video los enlaces están bien pero alguién puede estudiar solo por los contenidos e no se aperceber de lo error! 🙂 Gracias por los videos!!
Soraia, 11 Años Antes
Hola, una pregunta. ¿Cómo se coloca el orbital desapareado pz del boro? ¿Cómo se explica que este se «haga a un lado» para que se forma la geometría trigonal planar?
Gracias de antemano 🙂
José Herminio Jiménez Sánchez, 9 Años Antes
¡Hola! Cuando tienes hibridación sp2, el orbital p que no se hibrida queda perpendicular al plano, si bien no es que se haga a un lado sino simplemente que queda vacío, por lo que al no tener ningún electrón no hay molestia posible. Espero que se comprenda. Un saludo grande.
QuimiTube, 9 Años Antes
Una pregunta para la hibridacion se requiere energia?
Diego, 9 Años Antes
Hola Diego, sí, porque hay una promoción electrónica, y esto siempre hace que se necesite energía (un electrón no puede saltar a un nivel superior sin un aporte energético). Sin embargo, este aporte energético inicial queda compensando posteriormente en el proceso por la formación de una mayor cantidad de enlaces, lo que hace que se libere más energía que si se formasen menos enlaces.
QuimiTube, 9 Años Antes
Muy buena explicación en cada vídeo, me ha servido de mucho para mí exposición de hibridación de las moléculas, todo muy bien detallado. Muchas gracias realmente es de mucha ayuda. Un saludo grande.
Alondrq, 5 Años Antes