Contenido del Vídeo
Existen muchas reacciones reversibles de interés en las que una sustancia A se disocia para dar otras sustancias B y C. A este tipo de reacciones químicas se las denomina reacciones de disociación. En una reacción de disociación frecuentemente trabajamos con el denominado grado de disociación, representado por la letra griega alfa, α. El grado de disociación nos indica la cantidad en tanto por uno de reactivo que ha reaccionado o que se ha disociado. Por ejemplo, en la siguiente reacción reversible:
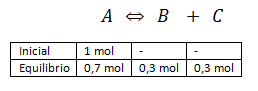
Inicialmente teníamos en el recipiente 1 mol de A y nada de B y C, pues al inicio la reacción de disociación aún no ha comenzado. Cuando el sistema alcanza el equilibrio, la diferencia, 1 – 0,7 = 0,3, es lo que se ha disociado del mol inicial, por lo que α = 0,3. El grado de disociación también puede expresarse en tanto por ciento, %, multiplicando α en tanto por uno por 100. Para el ejemplo dado, α% = 30%. Esto implica que el 30% del reactivo A inicial se ha disociado, mientras que el resto, un 70%, permanece sin reaccionar.
Valores de α próximos a 1 o de α% próximos al 100%, implican un alto rendimiento de la reacción hacia la derecha y valores de Kc altos, mientras que valores próximos a 0 indican que ha reaccionado una cantidad de reactivo A muy pequeña.
Se puede expresar el grado de disociación α como el cociente entre la cantidad, expresada en moles, de reactivo que ha reaccionado, x, y la cantidad inicial, no. Así:
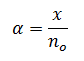
Donde:
x: moles que han reaccionado una vez alcanzado el equilibrio
no: moles iniciales que había del reactivo a
Despejando x de la expresión anterior:
![]()
El grado de disociación también se puede aplicar cuando los datos iniciales no vienen dados en moles sino en concentración:
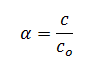
Donde:
c: concentración de A que ha reaccionado al alcanzar el equilibrio
co: concentración de A que teníamos inicialmente
Despejando c de la expresión anterior:
![]()
Veamos dos ejemplos concretos de expresión de los valores de Kc en función de grado de disociación de una reacción, cuando nos dan los datos iniciales en moles y cuando nos los dan en concentración. Para ello tomaremos como ejemplo la reacción de disociación del PCl5 para dar PCl3 y Cl2.
Con moles iniciales, no

Una vez deducida la concentración molar en el equilibrio de cada componente, en función del número de moles iniciales, no, del grado de disociación, α, y del volumen, podremos determinar la constante de equilibrio de la reacción como:
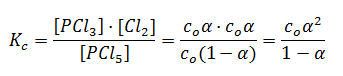
Con concentración inicial, co

Del mismo modo, cuando los datos iniciales vienen dados como concentración, una vez deducida la concentración molar de cada componente en el equilibrio, podremos expresar la constante de equilibrio de la reacción como:
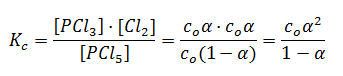
También te puede interesar:
Equilibrio Químico Teoría 2: Constante de equilibrio Kc. Ley de acción de masas.
Equilibrio Químico Teoría 3: Cociente de reacción Qc.
Category: Equilibrio Químico, Teoría de Equilibrio Químico y Vídeos Equilibrio Químico.
Etiquetas: Grado de disociación.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Profe, muchas gracias por todos los videos. A los estudiantes nos sirve muchisimo, y a mi en particular que no soy muy amante de la quimica con usted me termina gustando. Saludos desde Argentina, profe nunca dejes de hacer videos!!!
Gracias 😀
florencia, 9 Años Antes
Hola miss gracias por sus vídeos es de mucha ayuda ñ.
NATHALY CRISTINA MONTAO BURBANO, 4 Años Antes
¡Gracias a ti!
QuimiTube, 4 Años Antes
Tengo una duda, aquí es , tomando en cuenta el Kc, pero que pasa si mi reacción son con gases? cómo sería la relación con Kp?
Claudia, 8 Años Antes
¡Hola! Si lo que tienes son moles iniciales, seguramente te convendrá más calcular Kc y luego usar la expresión que relaciona ambas para calcular Kp:
http://www.quimitube.com/videos/constante-de-equilibrio-presiones-parciales-kp-relacion-con-kc
También puedes calcular las presiones parciales y luego de ahí sacar Kp…
Espero que te sirva el vídeo que te enlazo. Un saludo.
QuimiTube, 8 Años Antes
Muchas gracias por todos tus vídeos, sin ellos me sería muy difícil la química. Son de gran ayuda y están muy bien organizados, en especial para la selectividad. Muy bien explicados también. Gracias!
Javi, 8 Años Antes
Mil gracias por tu comentario Javi, un saludo grande.
QuimiTube, 8 Años Antes
Excelente curso
Alexander Franco, 7 Años Antes