Contenido del Vídeo
Las fuerzas dipolo instantáneo – dipolo inducido se dan entre moléculas covalentes apolares, e incluso entre átomos no enlazados, como es el caso de los gases nobles. Ya hemos visto previamente, en el caso del hidrógeno diatómico, H2, que las moléculas de hidrógeno se unen entre sí por una fuerza de 1 kJ/mol.
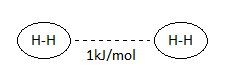
No obstante, cabe preguntarse, ¿cómo es posible que estas moléculas, totalmente apolares por estar formadas por dos átomos idénticos, establezcan entre sí una unión, por débil que sea? Se comprende que haya fuerzas de carácter electrostático entre moléculas covalentes polares pero… ¿entre las apolares?
Veamos, pues, la naturaleza de estas fuerzas. En las moléculas covalentes apolares, puede suceder que la nube electrónica, que estará en movimiento constante en torno a los núcleos atómicos, se halle más desplazada hacia un lado de la molécula durante un brevísimo lapso de tiempo.
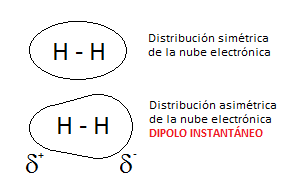
Así, la especie que es normalmente apolar, se puede volver fugazmente polar y formar un dipolo instantáneo. Además, por un proceso de inducción, este dipolo instantáneo puede provocar, a su vez, el desplazamiento de la nube electrónica de las nubes vecinas, formando lo que se conoce como un «dipolo inducido».
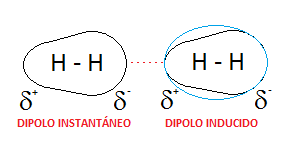
Estos dipolos sienten una cierta atracción mutua, de carácter débil (son dipolos con un desplazamiento de carga leve), que reciben el nombre de fuerzas dipolo instantáneo – dipolo inducido, o también fuerzas de London o fuerzas de dispersión.
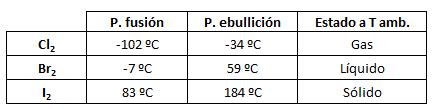
Una vez considera, por tanto, la naturaleza de estas fuerzas de London, cabe destacar que aumentan con el tamaño de la molécula y, por tanto, con la masa molecular. Esto es debido a que cuanto más grande es la molécula, más electrones tendrá, más grande será la nube electrónica y más alejada se hallará ésta del núcleo. Esto hace que, en la smoléculas grandes, sea más fácil la formación de dipolos instantáneos. Se dice que estas moléculas son polarizables.
Por ejemplo, si consideramos las moléculas diatómicas de los halógeno cloro, bromo y yodo, Cl2, Br2 e I2, sus puntos de fusión y ebullición y su estado de agregación a temperatura ambiente se pueden ver en la tabla siguiente:
De forma esquemática, podemos representar la nube electrónica de cada una de estas moléculas cada vez más grande y, por tanto, más polarizable, tal y como podemos ver en la siguiente figura:
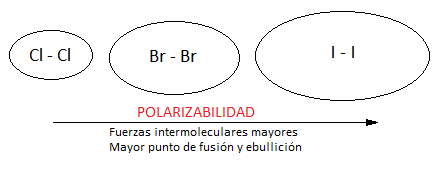
A pesar de esto, se cumple que las fuerzas de London o de dispersión son las más débiles de todas las fuerzas intermoleculares, por lo que, en general, las moléculas covalentes apolares presentarán bajos puntos de fusión y ebullición, aumentando en un mismo grupo con el tamaño atómico. Lo mismo ocurre con los gases nobles, que son átomos que no forman enlace, en los cuales el punto de ebullición superior corresponde, en efecto, al más grande de la serie, el radón, por ser el más grande de la serie. Como podemos ver, los puntos de ebullición crecen de menor a mayor:
- Helio: -269 ºC
- Neón: -246 ºC
- Argón: -186 ºC
- Criptón: -152 ºC
- Xenón: -108 ºC
- Radón: -62 ºC
Category: Enlace Químico y Teoría de Enlace Químico.
Etiquetas: Enlace covalente y Fuerzas intermoleculares.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Hola!
tengo la duda de que si las fuerzas de atraccion de london y el dipolo permanente-dipolo inducido son lo mismo. Gracias!
Malen, 12 Años Antes
¡Hola! Bueno, la clasificación de las fuerzas intermoleculares a veces varía un poco, pero si tienes un dipolo permanente normalmente se clasifican dentro de las fuerzas de van der Waals, y si los dipolos son instantáneos (y luego a su vez inducen otros) generando fuerzas de dispersión, entonces es a esas a las que llamamos fuerzas de London.
QuimiTube, 12 Años Antes
Gracias por la información, y la calidad de la explicación.
Juan, 12 Años Antes
Hola Juan, bienvenido y gracias a ti por comentar 🙂 Un saludo
QuimiTube, 12 Años Antes
Hola! Me gustaría que me recomendases páginas web para hacer ejercicios sobre polaridad y fuerzas intermoleculares. Me gustaría que fuese lo antes posible por favor.
Muchisimas gracias y enhorabuena por los videos!
Saludos
Andrea, 12 Años Antes
Hola Andrea, bienvenida. No tengo muy controlado el resto de material que hay por la web, pero aquí tienes muchos ejercicios resueltos de selectividad y seguro que encuentras de polaridad y fuerzas intermoleculares, así que espero que te sirvan.
http://www.spaindata.com/quimica/
Yo todavía tardaré unas semanas en subir esos ejercicios.
Gracias por comentar.
Un saludo,
Carmen
QuimiTube, 12 Años Antes
una pregunta???
en k consiste ls fuerzas ion-dipolo induido y las uerzas hidrofobicas. y un ejemplo de cada uno
giniva, 12 Años Antes
Hola Giniva, las fuerzas ión dipolo inducido serían las que se puedan establecer entre un ión, por ejemplo un catión sodio, Na+, o un anión cloruro, Cl-, con un compuesto apolar pero que pueda inducirse un dipolo por cercanía con una especie cargada como el ión, por ejemplo, el yodo, que tiene una nube electrónica grande y polarizable.
Por su parte, las fuerzas hidrofóbicas son fuerzas entre moléculas apolares, esencialmente serían las fuerzas dipolo instantáneo-dipolo inducido que se pueden dar entre distintas moléculas de yodo, I2, como verás aquí a pie de vídeo para el yodo:
http://www.quimitube.com/videos/enlace-quimico-ejercicio-40-propiedades-de-las-redes-cristalinas-bacl2-h2o-diamante-e-i2/
QuimiTube, 11 Años Antes
Hola, quisiera por favor saber si me podrias dar 2 ejemplos de formulas moleculares de una sustancia binaria cuyas moleculas no sean dipolos permanentes, es urgente, graciass!!!
Katya, 11 Años Antes
¡Hola! Imagino que se refiere a que sean sustancias formadas sólo por dos elementos (y por tanto distinta electronegatividad entre ellos), pero que se anulen los dipolos por geometría. Podría ser el CO2 y el metano, por ejemplo.
QuimiTube, 11 Años Antes
hola , quisiera saber si tenes alguna idea de como justificar un ejercicio en el cual me dan diferentes compuestos (alcano , alcohol, ácido , amina y una sal ) y me piden el punto de ebullición o de fusión en forma decreciente o creciente depende comparando sus fuerzas intermoleculares y justifique en simplesplalabras xq..?
muchas gracias
melany, 11 Años Antes
¡Hola Melany! Tenemos bastantes de es tipo, mira, puedes echar un vistazo a los ejercicios de enlace químico, los del final (más o menos del 36 al 46) son de justificación de diferentes propiedades físicas:
http://www.quimitube.com/ejercicios-de-enlace-quimico/
QuimiTube, 11 Años Antes
muchas gracias,..!
melany, 11 Años Antes
que es la fuerza de london
jose, 11 Años Antes
¡Hola! En el vídeo se explica.
QuimiTube, 11 Años Antes
Que bueno vídeos, me ayudan mucho. De antemano muchas gracias…pero aun tengo una duda, ¿como se da el enlace dipolo permanente-dipolo inducido?
Cesar Daniel, 11 Años Antes
¡Hola! Muchas gracias, me alegra que te sirvan. El enlace entre dipolos, sean permanentes o inducidos, siempre es una atracción electrostática entre los extremos de carga opuesta. Por ejemplo, si miras el caso del agua (dipolos permanentes) siempre la parte negativa de una molécula de agua se atrae electrostáticamente con la parte positiva de otra. Esto es lo que ocurre en cualquier tipo de interacción entre dipolos. Un saludo.
QuimiTube, 11 Años Antes
Like :3
:3, 11 Años Antes
Disculpa, porque en las moléculas CCl4 y SiCl4, el punto de eb. del CCl4 es mayor, si el SiCl4 tiene más electrones???
Sofía, 11 Años Antes
Excelente! 😀 mil gracias!
Lupita, 11 Años Antes
Gracias y bienvenida 🙂
QuimiTube, 11 Años Antes
por que las moleculas apolares estan formadas por dos atomos identicos
stefannia, 10 Años Antes
¡Hola! Porque su diferencia de electronegatividad es nula y por eso el enlace no es polar. Sin embargo, también puedes tener una molécula apolar formada por átomos distintos si se anula por geometría. Mira este vídeo: http://www.quimitube.com/videos/enlace-covalente-polaridad-de-enlace-y-polaridad-molecular/
QuimiTube, 10 Años Antes
Hola , quisiera saber que es un dipolo permanente, instantaneo e inducido
Angello, 10 Años Antes
Hola Angello, ¿has visto el vídeo y leído la explicación a pie de vídeo? Ahí puedes hallar lo que es cada tipo, así como también te puede servir ver primero este vídeo introductorio:
http://www.quimitube.com/videos/introduccion-a-las-fuerzas-intermoleculares
QuimiTube, 10 Años Antes
Geniales los videos! Muy útiles, y una gran calidad en la expresión, muchas gracias por la ayuda! 🙂
Alvaro, 10 Años Antes
Muchas gracias Álvaro, bienvenido.
QuimiTube, 10 Años Antes
Hola profesora;
me presento, mi nombre es Francisco y quiero agradecerle enormemente su labor, quisiera robarle un poco de su tiempo para poder expresarle brevemente lo que su trabajo y dedicación a influido sobre mi.
Nunca he sentido interés por estudiar y la ley del mínimo esfuerzo era mi lema, y es por eso que ahora me pasa factura, cuando terminé la ESO, tomé la decisión de elegir el bachiller que mas fácil me resultaba, el de artes, sin pensar las consecuencias que tendría, ahora a mis 23 años he decidido realizar lo que siempre me a llamado la atención, ingeniería mecánica, llevo 5 meses cursando y….eso si que necesitaría mas tiempo para expresarlo, no entendía nada, hasta llegué a pronunciar en alto en clase,((¿porque ha puesto usted un igual ahí?))a lo que la profesora de química me respondió, eso es un doble enlace….
No sabría decirle cuantas veces abre visto sus vídeos, pero si sé las veces que e pensado que gracias a esta plataforma me a dado ánimo a continuar con la carrera.
En fin después de todo este repertorio, llevo una semana esperando impaciente la nota y por fin me la a dado, estoy aprobado.
No me salio todo lo bien que esperaba, pero bueno, esta aprobado.
Sin mas quiero volver a repetirle, ///muchas gracias por todo profesora///
es un gesto precioso lo que usted hace y espero de todo corazón que la vida se lo recompense.
Un saludo y hasta su próxima clase.
posd;no he podido mandarle este mensaje de forma personal,daba error.
francisco, 10 Años Antes
Hola Francisco, me ha dejado impresionada tu comentario. Aunque digas que lo tuyo era la ley del mínimo esfuerzo, lo cierto es que has sido muy valiente para ponerte a estudiar ingeniería mecánica después de haber hecho un bachillerato artístico. ¡Y aprobar química! Ese aprobado, efectivamente, sabe a sobresaliente, aunque esperases una nota mayor creo que debes estar muy muy contento. Gracias por venir aquí a contar tu experiencia y a dejar este comentario que me ayuda tanto a continuar. Muchísimo ánimo para continuar tus estudios, no te rindas ahora que has logrado salvar este obstáculo, salvarás también los demás. Un abrazo.
QuimiTube, 10 Años Antes
hola nuevamente!
tengo otra duda:
Ordene los siguientes grupos de líquidos, de acuerdo a su punto de ebullición creciente:
N2; Cl2; CH4; CCl4.
Entendí la explicación del vídeo, pero no se como abarcar esta pregunta ya que están esas moléculas de CH4 y CCl4.
Nuevamente, gracias!
Agustin, 10 Años Antes
¡Hola! Cuando tienes dos moléculas tan semejantes que son ambas apolares por su geometría, a pesar de que los enlaces del CCl4 son mucho más polares que los del CH4, fíjate en la masa molecular. CCl4 tiene una masa molecular mayor, y esto hace que su punto de ebullición también lo sea.
QuimiTube, 10 Años Antes
gracias por tus explicaciones me han servido mucho
stefania, 10 Años Antes
Buenas tardes profesora, con todo el respeto le escribo con el fin de que me resuelva una duda la verdad estoy muy cofundida con las clases de fuerzas intermoleculares, dentro de las fuerzas de dispersion hay subclases de las mismas? los puentes de hidrogeno como se forman?
muchas gracias por su atencion, profesora.
Diana Carolina, 10 Años Antes
Muchísimas gracias por hacer vídeos de este tipo, me ayudan en mi estudio para la universidad
Saludos desde México
David, 9 Años Antes
Hola David, de nada, y bienvenido. Un saludo.
QuimiTube, 9 Años Antes
Hola tengo una pregunta de examen y necesito saber, el enlace sonico , covalente, de polo dipolo, si alguien me podría ayudar por que no entiendo. Gracias.
eisabel, 9 Años Antes
Hola, te sugiero que veas todos los vídeos de enlace químico, es la forma en que te quede todo claro, viéndolos en orden. Un saludo.
http://www.quimitube.com/videoscategory/enlace-quimico
QuimiTube, 9 Años Antes
Hola, muy buen vídeo tengo una consulta las fuerzas de london son más débiles que las fuerzas de keeson. a masa molar similar? gracias
Ricardo, 9 Años Antes
Hola Ricardo, sí, las fuerzas de London son bastante más débiles que las fuerzas dipolo-dipolo. Te sugiero ver también este otro vídeo: http://www.quimitube.com/videos/introduccion-a-las-fuerzas-intermoleculares
Verás que las dipolo-dipolo nosotros las hemos clasificado como Van der Waals.
Un saludo.
QuimiTube, 9 Años Antes
hola! me queda super claro lo de la polarizabilidad y tamaño molecular.. pero quiero saber que pasa con el potencial de ionización para las fuerzas de disperción de london. gracias
cami, 9 Años Antes
Hola Cami, no acabo de entender tu cuestión, ¿quieres decir qué relación existe entre la variación del potencial de ionización de un átomo y las intensidad de las fuerzas de London que presenta? Generalmente cuanto mayor es el tamaño del átomo menor es su potencial de ionización (es más fácil arrancar un electrón, está más lejos del núcleo y más apantallado) y también presenta fuerzas de London más fuertes por ser más polarizable.
QuimiTube, 9 Años Antes
me podría dar por favor mas ejemplos sobre los enlaces intermoleculares de las fuerzas de London
Angie Gomez, 9 Años Antes
¡Hola! Cualquier molécula apolar presentará este tipo de fuerzas. Por ejemplo las diatómicas: H2, F2, Cl2, O2, I2, Br2… O también otras que no son diatómicas pero son apolares por su geometría: CH4, CO2…
QuimiTube, 9 Años Antes
Hola muy buena información. Quisiera saber un libro donde pueda encontrar toda esta información ?
Camila Mena, 9 Años Antes
¡Hola! Te sugiero cualquier libro de química general, por ejemplo el Brown, si es para nivel universitario. Si no es para nivel universitario te sugiero cualquier libro de 2o de bachillerato, especialmente el de santillana http://www.quimitube.com/libro-de-texto/quimica-2-bachillerato-santillana-2009-isbn-978-84-294-0993-2. Un saludo.
QuimiTube, 9 Años Antes