Contenido del Vídeo
Cuando tenemos moléculas covalentes polares, éstas forman un dipolo permanente que establecerá fuerzas electrostáticas con los dipolos de las moléculas vecinas.
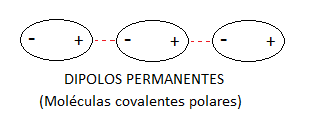
Aunque la polaridad del enlace covalente y de las moléculas covalentes lo hemos trata en profundidad en un apartado previo (podéis ir a través del enlace) vamos a repasar brevemente qué tiene que ocurrir para que una molécula covalente sea polar:
- Que algunos de sus enlaces o todos ellos sean polares, por estar formados por átomos con distinta electronegatividad, es decir, enlace intramoleculares con un momento dipolar permanente (distribución asimétrica de la carga). El átomo más electronegativo atrae hacia sí los electrones del enlace.
- Que los momentos dipolares de los distintos enlaces de la molécula no se anulen entre sí por geometría, de forma que la molécula presente un momento dipolar total neto distinto de cero.
Por tanto, existen moléculas covalentes polares en función de la diferencia de electronegatividad de sus átomos y de su geometría, por lo que formarán dipolos permanentes que se atraerán entre sí por fuerzas electrostáticas.
Aunque la naturaleza de este tipo de fuerzas intermoleculares siempre es la misma, la formación de dipolos permanentes, se clasifican en dos tipos de fuerzas distintas:
- Enlaces de hidrógeno. Cuando la molécula polar presenta enlaces formados por un átomo de hidrógeno y un átomo pequeño y electronegativo (nitrógeno, oxígeno o flúor; N,O,F). Dentro de los dos tipos de fuerzas intermoleculares entre moléculas polares son los más intensos, y oscilan, generalmente, entre 8 y 40 kJ/mol.
- Fuerzas de van der Waals. Clasificaremos las fuerzas intermoleculares dentro de este grupo cuando tengamos el resto de combinaciones posibles, es decir, cualquier enlace polar que no esté formado por hidrógeno enlazado a N,O,F. Suelen oscilar de 0,1 a 30 kJ/mol (este último valor tan elevado, en casos particulares)
En primer lugar, para tratar en mayor profundidad los enlaces de hidrógeno (también llamados puentes de hidrógeno), consideraremos la molécula de agua, que es una molécula covalente polar. Dado que los enlaces de esta molécula son O-H, se clasificarán como «enlaces de hidrógeno», que podemos representar como:
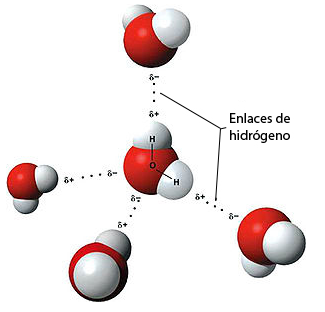
Fuente: https://www.asturnatura.com
Puesto que los enlaces de hidrógeno presentan en general una intensidad mayor que las fuerzas de Van der Waals, las moléculas que los forman presentan unos puntos de fusión y ebullición anormalmente elevados, en comparación con los compuestos análogos de su mismo grupo. En el caso del grupo de los anfígenos: H2O, H2S, H2Se y H2Te, los puntos de ebullición son:
H2O: 100ºC
H2S: -59,6ºC
H2Se: -42ºC
H2Te: -1,8ºC
El punto de ebullición del agua, por ser el de menor masa molecular, debería ser el menor de todos ellos, dado que sabemos que, en general, a mayor masa molecular de una sustancia mayor punto de ebullición. Sin embargo vemos que es el mayor de la serie y con una diferencia muy considerable. Esto es debido que, puesto que en las moléculas de agua se forman enlaces de hidrógeno, costará más separarlas, habrá que aportar una mayor cantidad de energía y, por tanto, mayor temperatura. De hecho, es la formación de enlaces de hidrógeno lo que le confiere sus peculiares propiedades físicas que la hacen un compuesto indispensable para el desarrollo de la vida y la química de los seres vivos, pues la inmensa mayoría de reacciones que se dan en las células tiene lugar en disolución.
Además, la formación de puentes de hidrógeno es también la causa de la estructura altamente ordenada del hielo. En la siguiente imagen podemos ver ambas estructuras, la del agua líquida y la del agua sólida:
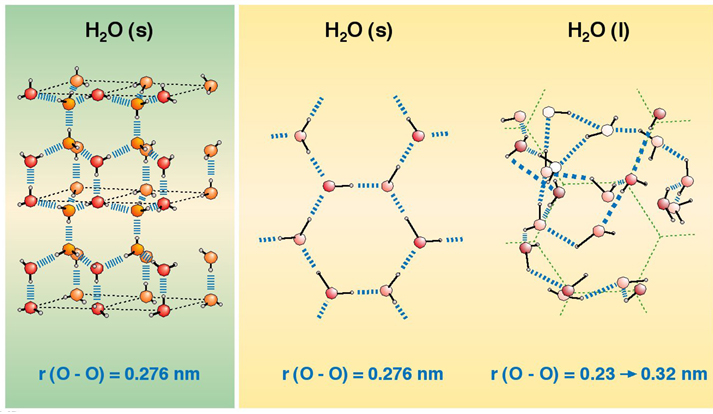
Estructura del agua líquida y del agua sólida
Fuente: https://old.iupac.org/didac/
Otras moléculas de la serie, como H2S y H2Se, serán levemente polares (electronegatividad del S: 2,5; electronegatividad del Se: 2,4; electronegatividad del H: 2,1). Pero, dado que las diferencias de electronegatividad son pequeñas, la magnitud de los dipolos permanentes formados será muy inferior a la de las moléculas de agua y, por este motivo, también será menor la magnitud de las fuerzas intermoleculares formadas (que en este caso serán Fuerzas de Van der Waals o dipolo-dipolo, por no cumplir las condiciones para ser designadas como enlaces de hidrógeno). Por este motivo, costará menos separar las moléculas y sus puntos de ebullición son muy inferiores a los del agua, a pesar de tener mayor masa molecular.
Asimismo, en el vídeo hablaremos de algunos ejemplos de moléculas que presentan puentes de hidrógeno (amoniaco, fluoruro de hidrógeno, compuestos orgánicos como alcoholes, aminas, ácidos carboxílicos…) y de moléculas que presentan fuerzas de van der Waals o dipolo-dipolo (clorometano, cloruro de hidrógeno…).
Category: Enlace Químico y Teoría de Enlace Químico.
Etiquetas: Enlace covalente y Fuerzas intermoleculares.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Información Bitacoras.com…
Valora en Bitacoras.com: Cuando tenemos moléculas covalentes polares, éstas forman un dipolo permanente que establecerá fuerzas electrostáticas con los dipolos de las moléculas vecinas. Aunque la polaridad del enlace covalente y de las moléculas cova…..
Bitacoras.com, 12 Años Antes
Muy buena, me esta sirviendo de gran ayuda! pero tengo una duda, porque el aumento de Z hace que los enlaces intermoleculares sean mas fuertes? tendria que ser al reves xq tiene una nube de electrones mayor y por lo tanto la repulsion de las nubes de electrones de los 2 elementos es mayor no?
manuel, 12 Años Antes
Hola Manuel, bienvenido. En realidad lo que ocurre es que al aumentar Z y aumentar por tanto la nube electrónica, crece mucho el volumen atómico. Es cierto que habrá más repulsión, pero también se hallan más alejados del núcleo (muchísimo más alejados) y por este motivo están menos afectados por la carga nuclear y les resulta más fácil polarizarse, es decir, desviarse de la nube electrónica inicial. Además, si consideramos las fuerzas intermoleculares en términos de energía que hay que aportar para que el compuesto se evapore, el de mayor Z cuesta más evaporarlo por ser más pesado. Espero que se entienda. Un saludo.
QuimiTube, 12 Años Antes
Puaf muchas gracias ya lo entiendo, el examen esta aprobado gracias a esta pagina! jajaja
Saludos.
manuel, 12 Años Antes
Mucha suerte 😀
QuimiTube, 12 Años Antes
Que genial esta pagina, la profe una genia.. graciass!
Erina Claveria, 11 Años Antes
¡Muchísimas gracias a ti por el comentario! 😀
QuimiTube, 11 Años Antes
🙂 …… Excelente pagina, muchas felicidades….me haz salvado la vida ….. estudio Ingenieria Ambiental…y esto de la Quimica como que no me gustaba…pero ya me encanto gracias ati
ilik3dg4r, 11 Años Antes
¡Hola! Me alegra mucho esto que me dices, que pase de no gustarte la química a gustarte aunque sólo sea un poquito es una gran alegría 🙂 Un saludo muy grande y ánimo con esa ingeniería.
QuimiTube, 11 Años Antes
Gracias, felicitaciones por el esfuerzo, en serio me han salvado la vida, estoy en la escuela y acabo de ver esto y con esto apruebo el examen, ya que el profesor había explicado y no le había entendido, muchísimas gracias y muchos éxitos.
Saludos.
Gianfranco Cornejo, 11 Años Antes
Muchas gracias Gianfranco y bienvenido. Espero que te vaya fenomenal tu examen, ya me contarás 🙂 Un saludo grande
QuimiTube, 11 Años Antes
Muchas gracias por el vídeo, está explicado de una manera muy didáctica, y ahora entiendo de una manera más clara el concepto de fuerzas de Van der Waals; Sólo tengo una duda, a los 11:20 minutos del vídeo se dice que el punto de ebullición del sulfuro de hidrógeno es mayor que el del agua, y me parece que es lo contrario.
Daniel, 11 Años Antes
Hola Daniel, gracias por tu comentario. En efecto, si he dicho eso lo he dicho al revés, el punto de ebullición del agua es mayor que el del sulfuro de hidrógeno porque presenta enlaces de hidrógeno. Un saludo grande.
QuimiTube, 11 Años Antes
Que Bien Explicado Esta Todo ! Antes que nada felicitarla por el esfuerzo y la dedicación , y por la enorme ayuda que me propinan sus cursos. me ayudara mucho para ingresar a la universidad 🙂 un gran abrazo señorita .
Alexander, 11 Años Antes
Hola Alexander, muchísimas gracias por tu comentario de apoyo 🙂 Me alegra que te sirva, mucho ánimo con tus estudios y suerte con tu ingreso a la universidad. Un saludo grande.
QuimiTube, 11 Años Antes
tengo una pregunta ¿pueden existir enlaces de hidrógeno entre dos compuestos apolares ej: entre el fenol y el etanol? excelentes videos me ayudaron mucho. gracias
Cristian, 11 Años Antes
Ahora si! Mucha más claridad en el tema 😀
Lupita, 11 Años Antes
Me alegra que te sirva 🙂 ¡Un saludo!
Quimitube, 11 Años Antes
¡Sos una ídola profe! Mil gracias, en serio, estoy en los primeros exámenes para el ingreso en ingeniería química y esta clase me ayudó muchísimo. Admiro bastante tu dedicación, porfa sigue así y tendré ingreso asegurado jaja 😀 ¡Saludos!
Karen, 11 Años Antes
Mil gracias Karen, espero que el ingreso te vaya fenomenal. Un fuerte abrazo.
QuimiTube, 11 Años Antes
de mucha ayuda grasias
rolando p, 11 Años Antes
¡De nada!
QuimiTube, 11 Años Antes
El Se al ser un semimetal se considera metal? y forma entonces enlaces covalentes?
Cristina, 10 Años Antes
Perdón, quería decir el Te forma un enlace covalente con el H?
Cristina, 10 Años Antes
¡Hola! Una forma de determinar si el enlace es covalente o iónico (o en qué grado) es mirando la diferencia de electronegatividades de ambos: http://www.quimitube.com/videos/enlace-quimico-ejercicio-10-calculo-del-porcentaje-de-caracter-ionico-con-la-diferencia-de-electronegatividades/ En el caso del Te y el H la diferencia de electronegatividad es inferior a 1,7 (de hecho es 0) y lo consideramos como un enlace covalente.
QuimiTube, 10 Años Antes
[…] disolvente las partículas se sinterizan (se unen por acción del calor) y quedan unidas mediante fuerzas de van der Waals. Además el calentamiento funde al polímero y mejora las propiedades físicas del producto final. […]
El mundo en una pelota…. y su ciencia | Hablando de Ciencia | Artículos, 10 Años Antes
Hola!! Lo principal darle la enhorabuena profesora…jaja está todo superclaro, pero tengo una duda con respecto a mis apuntes…
«Los enlaces de hidrógeno, comparados con otras fuerzas intermoleculares, son relativamente fuertes; sus energías son del
orden de 15 a 40 kJ/mol. Sin embargo, son mucho más débiles que los enlaces covalentes simples que tienen energías de enlace superioresa los 150 kJ/mol»
Entonces mi duda es que no se cuales son los enlaces covalentes simples, ya que según lo que yo he entendido los puentes de hodrógeno son los enlaces mas fuertes dentro de los enlaces covalentes.
Un saludo
Pedro, 10 Años Antes
¡Hola! Lo que ocurre es que los enlaces de hidrógeno no están dentro de los enlaces covalentes, que son intramoleculares (dentro de una misma molécula) sino en las llamadas fuerzas intermoleculares (entre dos moléculas distintas). Así, los enlaces de hidrógeno son las fuerzas intermoleculares más fuertes de todas, pero mucho más débiles que un enlace covalente normal, que es el enlace propiamente dicho, por ejemplo, en la molécula de agua, H2O, sería enlace covalente el enlace O-H, pero el enlace de hidrógeno sería entre dos moléculas de agua distintas, H-O-H………OH2
QuimiTube, 10 Años Antes
Porque suceden los enlaces de hidrogeno?
Maria, 10 Años Antes
¡Hola! Porque los enlaces que presentan un momento dipolar tienen una zona positiva y otra negativa, y eso hace que se puedan atraer por fuerzas electrostáticas las zonas de signo contrario. Te recomiendo ver el vídeo de nuevo. Un saludo.
QuimiTube, 10 Años Antes
Hola que tal me gusto mucho tu explicación pero al ver el vídeo me surge la interrogante de que si el agua a pesar de tener el menor peso molecular de 18 g/mol presenta el punto de ebullición mas alto,(esto gracias a los puentes de hidrogeno) cual debería ser el peso molecular que tendria que tener esta molecula sin tomar en cuenta los enlaces??? solo para ejemplificar la diferencia entre pesos moleculares.
jesus, 10 Años Antes
Hola Jesús, si te fijas en los otros tres valores, aproximadamente forman una línea recta. Podrías representar en una línea los pesos moleculares de los distintos compuestos frente a su punto de ebullición, y sacar la ecuación de dicha recta. Después, con esa ecuación, sustituyendo el valor del peso molecular del agua, podrías calcular fácilmente el valor del punto de ebullición esperado. Un saludo.
QuimiTube, 10 Años Antes
hola!
que fuerza intermolecular existe entre moléculas de CH3F?
la respuesta según el sitio es: dipolo-dipolo, pero yo creo que son puentes de hidrógeno, ya que quedarían fuerzas entre F y H…. de antemano, gracias 🙂
Agustin, 10 Años Antes
¡Hola Agustín! Para ser enlaces de hidrógeno el flúor tendría que estar enlazado directamente al hidrógeno (enlaces F-H, N-H u O-H), pero en este caso está enlazado al carbono. Así, digamos que las fuerzas de atracción son C-F—–H, y por este motivo se clasifican como dipolo-dipolo. Un saludo.
QuimiTube, 10 Años Antes
Hay una pregunta que no entiendo y dice algo mas o menos así
Cuales son los enlaces quimicos que presentan las moléculas orgánicas y la fuerza de van ser waals?
Ojala me puedan ayudar
Gracias!
Karla mendez, 9 Años Antes
¡Hola! Las moléculas orgánicas suelen presentar enlaces covalentes en todos sus enlaces, aunque la segunda parte de «y la fuerza de van der waals» no entiendo bien a qué se refiere la pregunte. ¿Quiere decir si las moléculas orgánicas las presentan?
QuimiTube, 9 Años Antes
Profesora, me queda una duda:
El acido acetico o cualquier otra molecula que tenga cooh en su cabeza puede formar puentes de hidrogeno con el agua, pero los oxigenos y el carbono del cooh también forman puentes de hidrogeno? esto porque el oxigeno queda con ese dipolo negativo, y el carbono con dipolo positivo no? (en el caso del carbono con carga positiva, seria un puente de van de waals) o me equivoco? Espero haberme explicado con claridad.
Desde ya muchas gracias 🙂
Nicolás, 9 Años Antes
Hola Nicolás, efectivamente el oxígeno con carga negativa formará enlace con el agua de bastante intensidad, mientras que en el caso del carbono no serán puentes de hidrógeno sino únicamente fuerzas de van der Waals porque para que sea puente de hidrógeno, tienes que tener oxígeno, flúor o nitrógeno. Un saludo grande.
QuimiTube, 9 Años Antes
GRACIAS POR LA PRONTA RESPUESTA!! y otra duda:
en el caso de cuando se juntan 2 acidos etanoicos como muestra esta imagen
http://www.rena.edu.ve/cuartaEtapa/quimica/imagenes/T13Dib4b.gif
la molecula sigue siendo soluble en agua porque los oxigenos del cooh aun pueden hacer puentes de hidrogeno? o por que los puentes de hidrogeno entre los dos acidos etanoicos se rompen para interaccionar con moleculas h2o?? :S
Nicolás, 9 Años Antes
Hola, muy buenos tus videos y explicaciones. Tengo una pregunta: ¿a qué se debe la diferencia entre los puntos de ebullición del agua y el amoniaco si ambas moléculas son polares, tienen uniones por puentes de hidrógeno y sus masas moleculares son similares?
Gracias
Cayetana, 9 Años Antes
Hola Cayetana, el momento dipolar de la molécula de agua es mayor que en el amoníaco y por tanto la molécula de agua es más polar y los enlaces de hidrógeno entre estas son más fuertes que en el amoníaco. Es decir, aunque cualitativamente lo podemos describir igual, cuantitativamente no, por lo que para separar entre sí moléculas de agua hace falta más energía que para separar entre sí moléculas de amoníaco. Esto hace que el punto de ebullición del agua sea mucho mayor. Un saludo grande.
QuimiTube, 9 Años Antes
Muchísimas gracias por responderme y además tan rápido. Lo imaginaba porque la electronegatividad del oxígeno es mayor que la del nitrógeno, pero no estaba segura de si era por esto o porque las uniones con puentes de hidrógeno en el agua tienen una estructura diferente a las del amoniaco.
Un saludo muy muy agradecido.
Cayetana, 9 Años Antes
primero felicitaciones , y ahora una pregunta quizás, es obvia, pero después de tanto tiempo haber dejado los estudio, y estar estudiando a distancia no lo recuerdo si me lo explicaron antes, no entiendo, como un compuesto puede tener punto de ebullición negativo, pues el agua es fácil entenderlo a 100ºC, hierve o llega a su punto de ebullición pero, como es que por ejemplo el Cl2 llega a su punto de ebullición a -34 ºC, a esa temperatura estaría hirviendo?, me lo puedes explicar, o aconsejar algún vídeo, no es que me lo pidan saber pero creo que tendría que tenerlo claro. gracias me ayudaste montón con mi examen y ahora preparo el siguiente.
yanett, 8 Años Antes
Hola Yanett, sí, por debajo de -34 ºC el Cl2 sería un líquido y al alcanzar los -34 ºC empezaría a hervir para convertirse en un gas, tal y como es a temperatura ambiente. Lo que ocurre es que la escala absoluta de temperaturas, aquella en la que todas las temperaturas son positivas, es la escala kelvin. En este caso, por ejemplo, el Cl2 herviría a 239 K. Como la escala centígrada se basa en la kelvin pero es distinta, ocurre que hay temperaturas negativas, pero solo es eso, una escala, una referencia que tomamos en la medida. Por eso es indiferente que el punto de ebullición de un compuesto sea negativo o positivo. Espero haberte aclarado algo. Un saludo.
QuimiTube, 8 Años Antes
Buenas tardes! Me encantan tus vídeos. Haces una gran labor explicando la química tan bien como lo haces. Espero que sigas haciendo lo que haces, que nos ayudas mucho a los estudiantes. Eres genial!!! Un abrazo grande.
Alina, 7 Años Antes
¡Muchísimas gracias! Ahora que vuelvo a estar activa en la página estos comentarios me dan fuerza. Un saludo grande.
QuimiTube, 4 Años Antes
[…] http://www.quimitube.com/videos/enlaces-de-hidrogeno-y-fuerzas-de-van-der-waals […]
¿Por qué el aire caliente puede contener más vapor que el frío? – Deep Funk, 7 Años Antes
La fuerza de Van Der Waals es de mayor intensidad que la de un puente de hidrógeno?
Melii, 6 Años Antes
¡Hola! La de mayor fortaleza es la de hidrógeno.
QuimiTube, 4 Años Antes
Por qué el CO2 y el H2O no forman enlace de Hidrógeno?
Jorge, 6 Años Antes
Hola Jorge, el H2O sí forma enlace de hidrógeno, tal y como explicamos en el vídeo y en el contenido de pie de vídeo. El CO2 no forma porque no tiene hidrógeno, ya que para que haya enlace de hidrógeno necesitas enlaces en los que tengas H y un átomo pequeño y electronegativo como oxígeno, flúor o nitrógeno.
QuimiTube, 4 Años Antes