Contenido del Vídeo
En este ejercicio debemos indicar las propiedades físicas diferenciales que tendrán el cobre, el dióxido de carbono y el fluoruro de cesio a partir de los enlaces de cada uno de ellos.
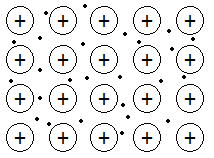
El cobre es un sólido metálico y, como tal, está formado por una red cristalina de cationes cobre y presenta electrones deslocalizados, que pueden moverse con libertad por toda la red cristalina. Por este motivo tendrá elevada conductividad eléctrica y térmica. Además, al ser una red cristalina, es un compuesto duro y compacto, aunque es dúctil y maleable, como son en general los metales, porque la movilidad de unas capas catiónicas sobre otras no provocan la ruptura del sólido. Además, sus puntos de fusión y ebullición serán elevados, como consecuencia de la fortaleza del enlace metálico. No es soluble en agua.

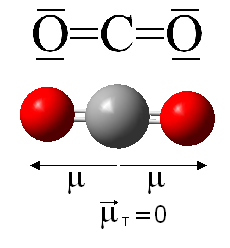
En cuanto al dióxido de carbono, se trata de una molécula covalente lineal. Aunque sus enlaces son polares (la electronegatividad del oxígeno es de 3,5 y la del carbono 2,5, por lo que la diferencia es de 1,0) será globalmente apolar por geometría. Por este motivo, el CO2 es un gas a temperatura ambiente y en general presenta puntos de fusión y de ebullición muy bajos, ya que las únicas fuerzas intermoleculares que podrán presentar entre sí distintas moléculas de CO2 serán fuerzas de dispersión o de London, por formación de dipolos instantáneos. No será conductor de la corriente eléctrica, ya que está formado por moléculas aisladas, y los electrones no tienen libertad de movimiento en un enlace covalente. Además, tampoco será soluble en agua.
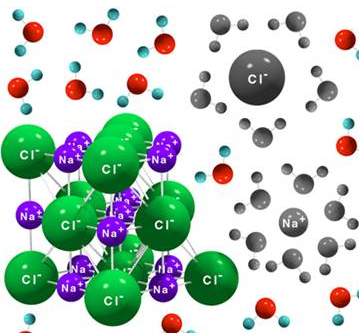
Finalmente, el fluoruro de cesio es un compuesto iónico, ya que está formado por un átomo muy electronegativo, el flúor (electronegatividad del flúor = 4,0) y un átomo muy poco electronegativo, el cesio (electronegatividad del cesio = 0,7), por lo que la unión de ambos dará lugar a una red cristalina formada por cationes Cs+ y por aniones F-, que tendrá elevada dureza, aunque será frágil. También presentará elevados puntos de fusión y de ebullición, porque habrá que vencer las fuerzas de atracción electrostática para separar los iones y fundir o evaporar el compuesto. Adeemás, será soluble en agua porque la molécula de H2O forma dipolos permanentes capaces de solvatar los iones. No conducirá la corriente eléctrica en estado sólido, pero sí lo hará en estado disuelto o fundido por la capacidad de movilidad de los iones.
A continuación vemos un ejemplo de la disolución de un compuesto iónico en el agua, el NaCl, cloruro de sodio, que es análoga a la disolución del fluoruro de cesio en agua:
También te puede interesar:
Cambios físicos: fundir cloruro potásico, hervir agua y disolver yodo en benceno
Razonar ciertos hechos experimentales, Cl2 y KCl, NaF y F2, Ag y AgCl
Solubilidad de yodo y cloruro potásico en agua y tetracloruro de carbono
Propiedades de las redes cristalinas BaCl2, H2O, Diamante e I2
Category: Enlace Químico y Vídeos de Ejercicios de Enlace Químico.
Etiquetas: Enlace covalente, Enlace iónico, Enlace metálico y Fuerzas intermoleculares.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
gracias !
alma marcela gozo, 4 Años Antes