Contenido del Vídeo
En este ejercicio vamos a determinar qué fuerzas intermoleculares es necesario vencer o romper para producir una serie de cambios físicos, es decir, ciertos cambios de estado de las sustancias que no implican cambio químico, no hay reacción química. El enunciado completo es:
Indica qué tipo de fuerzas intermoleculares hay que vencer para:
a) fundir el hielo
b) sublimar yodo
c) vaporizara amoníaco
Para la fusión del hielo se debe romper la precisa estructura de enlaces de hidrógeno que mantiene la estructura cristalina formada, tal y como se muestra en la siguiente figura:
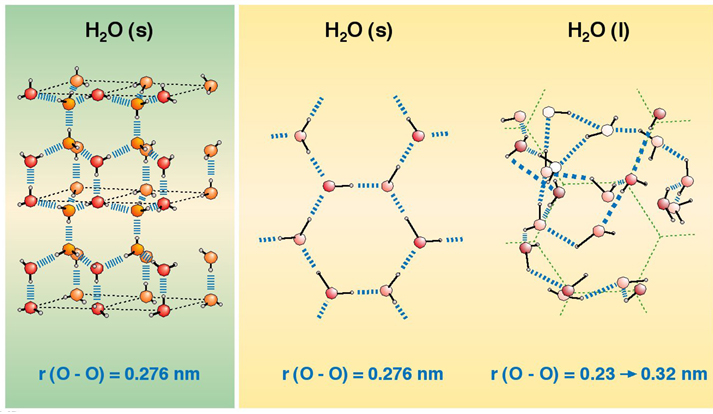
Vemos que en al agua líquida, una vez fundido el hielo, seguirán existiendo enlaces de hidrógeno que mantienen las moléculas de agua unidas en estado líquido, pero se trata de enlaces de hidrógeno con una disposición caótica y dinámica y no precisos y estructurados como en el hielo.
En cuanto al yodo, puesto que se trata de una molécula diatómica I2, formada por dos átomos idénticos, la diferencia de electronegatividad en el enlace I-I es nula y será totalmente apolar. Por ello, la única posibilidad que presenta esta molécula para formar dipolos es la formación de dipolos instantáneos, es decir, que en un momento dado, la nube electrónica se desplace más hacia un lado de la molécula provocando una distribución asimétrica de la carga (densidad de carga positiva, δ+, y negativa, δ-), ya que se trata de átomos grandes con una nube electrónica grande y polarizable. Así dará lugar a un dipolo instantáneo durante un breve instante de tiempo, que puede inducir dipolos en moléculas vecinas, dando lugar a dipolos inducidos.
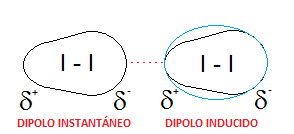
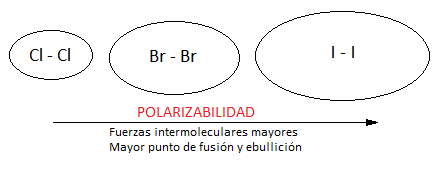
Las fuerzas que se establecerán entre moléculas de yodo serán dipolo instantáneo – dipolo inducido, que reciben el nombre de fuerzas de dispersión o fuerzas de London. Aunque se trata de fuerzas débiles, el hecho de que la molécula de I2 tenga una masa considerable hará que sea sólido a temperatura ambiente y que haya que romper estas fuerzas aumentando la temperatura para lograr sublimar el compuesto. Es decir, la intensidad de estas fuerzas intermoleculares depende de la masa del compuesto, como vemos en el siguiente esquema:
Por último, en el caso del amoníaco, dado que la geometría de la molécula es de pirámide trigonal, tal y como podemos predecir en base a la teoría de repulsión de pares electrónicos de la capa de valencia y como vemos en la siguiente figura:
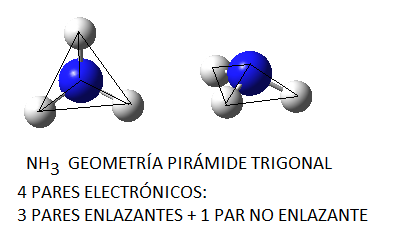
Y puesto que los enlaces N-H son polares (electronegatividad del nitrógeno de 3,0 y del hidrógeno de 2,1) esto hará que la molécula sea globalmente polar y que establezca interacciones dipolo permanente – dipolo permanente. Además, puesto que se trata de un enlace combinación de un átomo de hidrógeno y un átomo pequeño y electronegativo del grupo N,F u O, estas fuerzas estarán clasificadas como enlaces de hidrógeno. Por este motivo, son estas las fuerzas, es decir, los enlaces de hidrógeno, las que habrá que vencer para que el amoníaco líquido pase a estado gaseoso.
Category: Enlace Químico y Vídeos de Ejercicios de Enlace Químico.
Etiquetas: Fuerzas intermoleculares.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
gracias, el vídeo me sirvió mucho y eres hermosa por cierto 😀
miguel angel, 11 Años Antes
Gracias Miguel Ángel 🙂
QuimiTube, 11 Años Antes
Te kiero! muchas gracias por tus explicaciones y videos!!!
Manuel, 11 Años Antes
Jaja, ¡de nada!
QuimiTube, 11 Años Antes
Hola!, en primer lugar darte mil gracias por la enorme ayuda que está suponiendo para mi todo tu trabajo; mi duda es la siguiente: debido a mis pobres y olvidados conocimientos de matemáticas, la suma vectorial es algo de lo que me acuerdo muy de lejos, así que a la hora de determinar la polaridad global de la molécula nunca llego a comprender del todo cuándo se anulan y cuándo no los momentos dipolares, ¿algún truquillo?. Mil gracias nuevamente.
Noelia, 11 Años Antes
¡Hola! Muchas gracias 🙂 La suma vectorial se lleva a cabo por componentes, así que yo te recomiendo que te dibujes unos ejes de coordenadas, con centro de coordenadas en el átomo central de la molécula, y que después cada momento dipolar lo descompongas en su componente x y en su componente y. Si eres muy cuidadosa dibujando (mejor con papel de cuadritos) verás como te queda lo mismo en +x y en -x, y también en +y y en -y, y por eso se anulan. Espero que te sirva. Un abrazo.
QuimiTube, 11 Años Antes
Me ha servido muchisimo, he quedado fascinado, con la explicación, y la singular belleza de su presentadora
Juan García, 10 Años Antes
Muchas gracias, Juan, y bienvenido.
QuimiTube, 10 Años Antes