Contenido del Vídeo
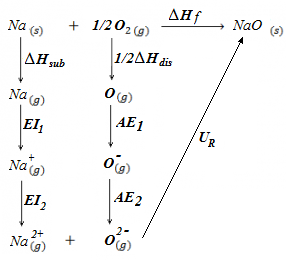
En este ejercicio se pretende justificar, mediante el uso del Ciclo de Born-Haber, la no existencia del óxido de sodio (II), es decir, NaO, con valencia +2 para el átomo de sodio. El enunciado completo es el siguiente:
Justificar, mediante el Ciclo de Born-Haber y los datos aquí indicados, la no existencia del compuesto NaO (Na(+2), O(-2)), suponiendo que su energía reticular fuese del orden de la del óxido de calcio, CaO, -3525 kJ/mol.
EI1 Na = 494 kJ/mol
(primera energía de ionización del sodio, es decir, la energía necesaria para abstraer el electrón de valencia del átomo y quedar como Na+).
EI2 Na = 4561 kJ/mol
(segunda energía de ionización del sodio, energía necesaria para abstraer un segundo electrón del Na+ para que quede como catión divalente, Na(2+)).
AE1 O = -142 kJ/mol
(primera afinidad electrónica del oxígeno, energía desprendida cuando el oxígeno neutro y gaseoso pasa al anión monovalente O(-)).
AE2 O = -791 kJ/mol
(segunda afinidad electrónica del oxígeno, energía desprendida cuando el anión oxígeno monovalente, O(-), pasa a. anión divalente, O(2-), más estable).
ΔH sub Na = 107 kJ/mol
(entalpía de sublimación del sodio, es decir, energía necesaria para pasar de sodio metálico sólido a sodio gaseoso).
ΔH dis O2 = 498 kJ/mol
(entalpía de disociación del oxígeno diatómico, es decir, energía necesaria para romper los enlaces covalentes O-O y tener átomos de oxígeno independientes y gaseosos).
También te puede interesar:
Ciclo de Born-Haber para el fluoruro sódico, NaF
Cálculo de la energía reticular del fluoruro de calcio, CaF2 por Born-Haber y Born-Landé
Cálculo de la energía reticular del bromuro potásico, KBr, por el Ciclo de Born-Haber
Cálculo de la energía reticular del óxido de magnesio, MgO, por el Ciclo de Born-Haber
Cálculo de la afinidad electrónica del cloro por el Ciclo de Born-Haber
Category: Enlace Químico y Vídeos de Ejercicios de Enlace Químico.
Etiquetas: Ciclo de Born-Haber y Enlace iónico.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad