Contenido del Vídeo
En este ejercicio vamos a determinar la energía reticular del óxido de magnesio, MgO. La diferencia con respecto a los ejercicios del Ciclo de Born Haber realizados previamente se halla en el hecho de que el anión oxígeno presenta una carga neta de -2, por lo que debemos considerar dos valores de afinidad electrónica, un primer valor para pasar de O(g) a O(-)(g), y un segundo valor para pasar de O(-)(g) a O(-2)(g). Del mismo modo, para el magnesio debemos considerar dos valores de energía de ionización, un primer valor para pasar de Mg(g) a Mg(+)(g), y un segundo valor para pasar de Mg(+)(g) a Mg(2+)(g), tal y como se puede apreciar en el esquema del ciclo de Born Haber.
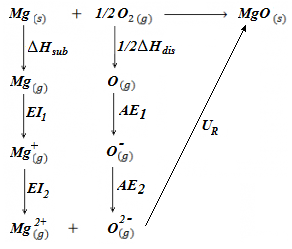
Los datos de que disponemos para realizar el cálculo de la energía reticular del óxido de magnesio son:
ΔHf (MgO) = -602,0 kJ/mol
(entalpía de formación del óxido de magnesio, energía desprendida cuando se forma un mol del compuesto sólido a partir de sus elementos en estado natural, es decir, magnesio metálico, sólido, y oxígeno como gas diatómico).
ΔHsub (Mg) = 146,1 kJ/mol
(entalpía de sublimación del magnesio, es decir, energía necesaria para que el magnesio metálico en estado sólido pase a magnesio vapor).
ΔHdis (O2) = 498,2 kJ/mol
(entalpía de disociación del oxígeno, energía necesaria para pasar de oxígeno diatómico gaseoso a átomos individuales de oxígeno en estado gaseoso).
EI1 (Mg) = 736,3 kJ/mol
(primera energía de ionización del magnesio, energía necesaria para abstraer un primer electrón de valencia y pasar de Mg(g) a Mg(+)(g)).
EI2 Mg = 1447,9 kJ/mol
(segunda energía de ionización del magnesio, energía necesaria para abstraer el segundo electrón de valencia y pasar de Mg(+)(g) a Mg(2+)(g)).
AE1 (O) = -141,2 kJ/mol
(primera afinidad electrónica del oxígeno, energía necesaria para pasar de O(g) a O(-)(g)).
AE2 (O) = -791,0 kJ/mol
(segunda afinidad electrónica del oxígeno, energía necesaria para pasar de O(-)(g) a O(2-)(g)).
Tal vez también te interese:
Ciclo de Born-Haber para el fluoruro sódico, NaF
Cálculo de la energía reticular del fluoruro de calcio, CaF2 por Born-Haber y Born-Landé
Cálculo de la energía reticular del bromuro potásico, KBr, por el Ciclo de Born-Haber
Cálculo de la afinidad electrónica del cloro por el Ciclo de Born-Haber
Demostrar la no existencia del compuesto NaO con el Ciclo de Born-Haber
Category: Enlace Químico y Vídeos de Ejercicios de Enlace Químico.
Etiquetas: Ciclo de Born-Haber y Enlace iónico.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Hola profesora, disculpe en algunos libros me dice que la AFINIDAD ELECTRONICA 2 DEL O-2 es positiva es endotermica porque el oxigeno llega a su configuracion de gas noble y es mas estable, quisiera saber si es verdad porque me mandaron este ejercicios y me mandaron a calcularla y me da positiva.
Jose, 10 Años Antes
Hola Jose, si es endotérmica entonces no sería más estable, sino menos. Cuando el oxígeno capta el segundo electrón le es costoso porque ya tiene una carga negativa inicial (O-1) y esto hace que «le cueste», pero después compensa muchísimo porque el ion óxido, O2-, puede formar redes cristalinas muy estables.
QuimiTube, 10 Años Antes
Como predigo la entalpia de formacion del CaS mediante el ciclo de born haber
camila, 10 Años Antes
Hola Camila, es muy similar a la del MgO, ten en cuenta que el calcio también forma un catión divalente, Ca2+, como el magnesio, y el azufre, S2-, como el oxígeno. Planteálo igual que el de este vídeo pero con esos iones.
QuimiTube, 10 Años Antes
Disculpe, no sé si yo olvidé realizar operaciones tan simples como la suma y la resta, pero como energía reticular Ur me da una energía de -2531,6 kJmol para el MgO
William, 10 Años Antes
Hola William, lo he estado revisando y a mí me sigue dando 2249 kJ/mol…
QuimiTube, 10 Años Antes
kJ/mol, perdón
William, 10 Años Antes