Contenido del Vídeo
En este ejercicio determinaremos la afinidad electrónica del cloro a partir del Ciclo de Born-Haber. Si bien es habitual en los distintos ejercicios de enlace químico usar dicho ciclo para calcular la energía reticular, en realidad podemos calcular cualquiera de los restantes parámetros implicados siempre y cuando dispongamos del resto de datos. En este caso, se trata del uso del ciclo de Born-Haber para el cloruro sódico.
El enunciado completo es:
Calcular la afinidad electrónica del cloro con los datos que se muestran a continuación:
Ur (NaCl) = -769,0 kJ/mol
(energía reticular del cloruro sódico, energía desprendida cuando se forma un mol del compuesto a partir de sus iones en estado gaseoso)
EI (Na) = 493,7 kJ/mol
(energía de ionización del sodio, energía necesaria para abstraer el electrón de valencia y formar el catión sodio, Na(+)).
ΔHf NaCl = -411,0 kJ/mol
(entalpía de formación del cloruro sódico, energía desprendida cuando se forma un mol del compuesto a partir de sus elementos en estado natural, es decir, el sodio metálico y el cloro gaseoso diatómico).
ΔH dis Cl2 = 242,6 kJ/mol
(entalpía de disociación del cloro, energía necesaria para romper en enlace Cl-Cl de un mol de moléculas y dar lugar a átomos de cloro individuales).
ΔH sub Na = 107,5 kJ/mol
(entalpía de sublimación del sodio, energía necesaria para pasar de sodio en estado sólido a sodio en estado gaseoso).
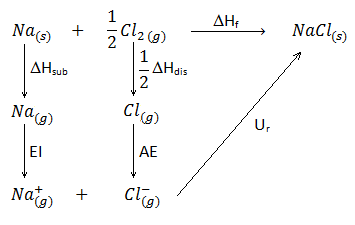
Tal vez también te interese:
Ciclo de Born-Haber para el fluoruro sódico, NaF
Cálculo de la energía reticular del fluoruro de calcio, CaF2 por Born-Haber y Born-Landé
Cálculo de la energía reticular del bromuro potásico, KBr, por el Ciclo de Born-Haber
Cálculo de la energía reticular del óxido de magnesio, MgO, por el Ciclo de Born-Haber
Demostrar la no existencia del compuesto NaO con el Ciclo de Born-Haber
Category: Enlace Químico y Vídeos de Ejercicios de Enlace Químico.
Etiquetas: Ciclo de Born-Haber y Enlace iónico.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad