Contenido del Vídeo
La polaridad de un enlace químico se da cuando existe una distribución asimétrica de la nube electrónica del enlace en torno a los dos átomos que forman dicho enlace. Esto sucede cuando ambos átomos tienen distinta electronegatividad. Por ejemplo, si consideramos la molécula de H2, formada por dos átomos idénticos, no hay distinta electronegatividad entre ellos y, por tanto, el enlace no es polar, sino apolar. La nube electrónica se distribuye de forma simétrica en torno a los dos átomos.
En cambio, en la molécula, por ejemplo, de HBr, al ser el bromo más electronegativo que el hidrógeno, atrae hacia sí los electrones del enlace químico y la nube electrónica quedará distribuida de forma asimétrica. Decimos que el enlace H-Br es polar y que, aunque la molécula globalmente sea neutra, por esta distribución asimétrica queda una densidad de carga negativa sobre el Br, lo cual representamos como delta(-), y una densidad de carga positiva sobre el hidrógeno, representada como delta(+). Delta(-) y delta(+) son iguales y de signo contrario.
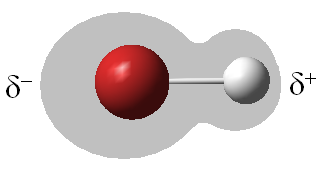
Así, en este enlace se genera lo que llamamos un dipolo eléctrico, porque tiene dos polos de signo contrario. Un dipolo eléctrico se caracteriza por el llamado momento dipolar (representado por la letra griega mu) que es el producto de delta (densidad de carga) por la distancia que separa los núcleos atómicos de los dos átomos del enlace, es decir:
![]()
d representa la distancia internuclear. En este caso, la distancia entre el núcleo del átomo de bromo y el núcleo del átomo de hidrógeno.
Este momento dipolar se puede medir experimentalmente. De hecho, fue el estudio del momento dipolar de distintas moléculas lo que permitió a Linus Pauling confeccionar su escala de electronegatividades.
Ahora bien, una vez considerada la polaridad del enlace covalente, debemos contrastar éste con la polaridad molecular. ¿Qué diferencia hay? Bueno, existen moléculas cuyos enlaces son polares y, sin embargo, globalmente son apolares por una cuestión de geometría. Es decir, debido a la geometría, los momentos dipolares de los enlaces individuales pueden anularse y, globalmente, la molécula será apolar.
Esto es lo que ocurre, por ejemplo, en el caso del dióxido de carbono, cuyos enlaces son polares porque existe una diferencia de electronegatividad entre el oxígeno y el carbono (electronegatividad del oxígeno 3,5; electronegatividad del carbono 2,5). Sin embargo, a pesar de la polaridad de los enlaces, puesto que se trata de dos momentos dipolares del mismo módulo pero distinto sentido, la molécula tiene un momento dipolar global nulo (ya que presenta geometría lineal), tal y como se representa a continuación:
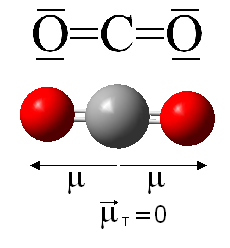
Esto mismo sucede con otras moléculas de distinta geometría que presentan enlaces equivalentes. Por ejemplo, la geometría trigonal plana de la molécula de trifluoruro de boro, BF3 o la geometría tetraédrica del metano, CH4.
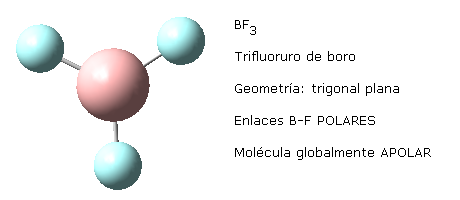
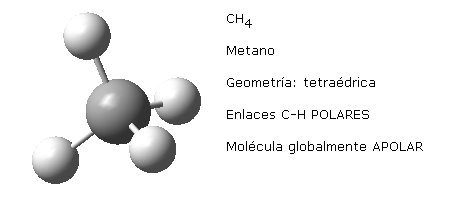
Nota: las imágenes moleculares aquí representadas han sido realizadas haciendo uso del programa Gauss View 5.0
Category: Enlace Químico y Teoría de Enlace Químico.
Etiquetas: Enlace covalente y Polaridad de enlace y polaridad molecular.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Información Bitacoras.com…
Valora en Bitacoras.com: La polaridad de un enlace químico se da cuando existe una distribución asimétrica de la nube electrónica del enlace en torno a los dos átomos que forman dicho enlace. Esto sucede cuando ambos átomos tienen distinta electroneg…..
Bitacoras.com, 12 Años Antes
Hola!
Como se calcula los valores de electronegatividad? quiero decir por ejemploe el Cl como se que valor de electronegatividad tiene?
Muchas gracias
dg, 12 Años Antes
¡Hola! Realmente no lo puedes calcular, te lo han de dar o debes tener una tabla a mano en la que se indiquen dichos valores. Lo único que sabes son valores relativos orientativos en función de la posición en la tabla periódica (si es de esperar que un elemento tenga mayor o menor electronegatividad que otro, pero poco más). La escala de electronegatividades actual la elaboró Pauling usando valores experimentales de momentos dipolares de algunas moléculas (se pueden medir) y es totalmente arbitraria. De hecho ni siquiera tiene unidades.
QuimiTube, 12 Años Antes
Muchas gracias!
dg, 12 Años Antes
La electronegatividad aumenta de izquierda a derecha, y de abajo para arriba en la tabla periódica, es por eso que el atomo mas electronegativo es el Flour.
carolina, 12 Años Antes
¿Por qué el cloro es más electronegativo que el carbono?Vale que el cloro esta mas a la derecha, pero el pero el carbono está por encima en su periodo y cuanto más «alto» sea el periodo mas aumenta la electronegatividad, no?Siempre he tenido esta duda al comparar elementos que se encuentran en un distinto periodo, pero que al compararlo con otro de un periodo inferior o mayor están muy a la derecha o la izquierda. Mi criterio sería que prevalece el periodo, pero obvio q no es así.
(sé que sería porque el radio del cl es mas pequeño y por lo tanto mas electronegativo,pero como sé yo esto…?la misma pregunta que antes pero con el radio…)no sé si me explico…
P.D: estaría bien un ejercicio de este tipo.El eje que pusiste es muy fácil ya que todos los elementos eran del mismo periodo jejeje
Muchas gracias y un saludo.
wilfred, 12 Años Antes
¡Hola! Lo cierto es que este problema con el que te encuentras es habitual, ¿por qué? Pues porque no tenemos en la tabla periódica nada que nos diga de forma exacta cuál prevalece… Es decir, es normal que te des con esta duda, nos ocurre a todos, a mí también. Y sí, en efecto puse un ejercicio muy fácil (jajaja, habrá que aumentar un poco la dificultad) pero precisamente suelen pedirse ejercicios así porque no es posible predecir con exactitud. Ten en cuenta que aunque se den unas pautas orientativas para predecir la electronegatividad en la tabla periódica, lo cierto es que Pauling determinó los valores de electronegatividad partiendo de datos experimentales de momentos dipolares.
En cuanto al radio sí que prevalece el periodo, porque cuando cambias de periodo añades una capa completa de electrones. Por este motivo, no es más pequeño el cloro (17 electrones) como dices, sino que es más pequeño el carbono (6 electrones).
QuimiTube, 12 Años Antes
Pero si la electronegatividad variaba en función de radio( Cuanto más pequeño el radio, más atrae el nucleo positivo a un electrón negativo, por lo tanto más electronegativo a radio mas pequeño no?
entonces si no me equivoco en mi razonamiento(q seguramente q si…), el carbono sería mas electronegativo…
Lo siento por darte tanto la lata(conmigo acabarás creando un foro jajajaaj…)
Un saludo y muchas gracias!
wilfred, 12 Años Antes
¡Hola Wilfred! Disculpa, se me había pasado responderte! Como bien dices, estamos trabajando en un foro jajaja, a ver si en un tiempo lo tenemos puesto en marcha para que podamos comentar cualquier tema y no ceñirnos tanto a un vídeo en concreto, y además para que otros usuarios puedan intervenir.
Pues el tema de la electronegatividad y el radio no es tan sencillo, no puedes hacer una analogía directa entre radio-electronegatividad. Si eso fuese así, habría átomos metálicos más electronegativos que otros no metálicos por la simple razón de tener un radio menor… Es más una cuestión de configuración electrónica: existen configuraciones electrónicas que tienen más tendencia a atraer hacia sí los electrones del enlace (el concepto de electronegatividad sólo tiene sentido para átomos enlazados) y esas configuraciones son las de los no metales, porque les faltan menos electrones para alcanzar la capa completa. Por tanto, el carbono no tiene por qué ser más electronegativo que el cloro, pues sus configuraciones electrónicas son distintas y sus tendencias a atraer los electrones del enlace también lo serán.
Un saludo enorme
QuimiTube, 12 Años Antes
Curradísima la web!!…(además de los videos tan chulos luego pones un resumen después)….
…Para tener en cuenta si enlace era covalente (y luego ya vemos el tema de la polaridad como en el video de aquí arriba) o ionico era >2 (o mejor dicho, muy superior a 2) la diferencia de electronegatividades que había que tener en cuenta para que el enlace no fuera covalente sino ionico?….o este criterio no hay que tenerlo muy en cuenta?….Un saludo!!
Pablo, 12 Años Antes
Hola Pablo, bienvenido, gracias por los ánimos, me hacen mucha ilusión 😀 En realidad yo no tendría muy en cuenta el criterio, como mucho de forma orientativa, ya que en realidad los enlaces tienen un porcentaje de carácter iónico y un porcentaje de carácter covalente, y los distintos enlaces se mueven en distintas proporciones. Sí que es cierto que si tienes una diferencia de elecronegatividad superior a 2 lo normal es que tengas enlace iónico, pero puede hacer variaciones al respecto. Un saludo grande.
QuimiTube, 12 Años Antes
Increible, 3 semanas dando esto en klase y ni idea… aki en 14 minutos klarisimo todo!! Un 10!! 🙂
Patxi, 12 Años Antes
Hola Patxi, bienvenido. Me alegro que te sirvieran y de haber sacado un excelente jejeje 😀
QuimiTube, 12 Años Antes
Buenas noches! queria preguntar porque todavia no comprendo cuando es polar o no polar una molecula? Gracias
Andrea, 12 Años Antes
¡Hola! ¿Has visto el vídeo completo? Creo que si vuelves a verlo la explicación te quedará más clara, porque se detalla bastante. También te recomiendo que leas la explicación que sale escrita a pie de vídeo, donde está explicado. De todos modos te digo aquí, como resumen, que una molécula será polar cuando tiene enlaces polares que no se anulan por geometría, y apolar cuando tiene enlaces apolares, o cuando tiene enlaces polares que se anulan por geometría. Un saludo.
QuimiTube, 12 Años Antes
Estuve consultando esta pagina por cuanto tenia dudas sobre la polaridad y la simetria de la molécula de CO2. Alguna vez leí en un libro de quimica ambiental que decia que el CO2 acumulaba energía por ser una molécula asimétrica, con los dos átomos de oxígeno formando un angulo120°, pero veo que es una molécula lineal y no es asimétrica. Gracias por la información.
Guillermo Pincay
Guillermo Pincay, 11 Años Antes
Hola Guillermo, en efecto la molécula de CO2 es totalmente lineal, y esto hace, precisamente, que sea una molécula apolar porque los momentos dipolares de sus dos enlaces se anulan, por lo que tiene un punto de fusión muy bajo. En ese libro metieron la pata… Un saludo.
QuimiTube, 11 Años Antes
Hola si me piden la definición de polaridad de enlace y la de polaridad de moleculas. Me parecen muy parecidas y no lo entiendo bien
Diana, 11 Años Antes
Hola Diana, la polaridad de enlace es de un único enlace A-B, fijándote en el momento dipolar de ese enlace. En cambio la polaridad molecular es fijándote en los vectores momento dipolar de todos los enlaces que intervienen en la molécula y considerando su vector resultante, que sería la polaridad molecular.
QuimiTube, 11 Años Antes
excelente explicacion y que linda esta la profe jajaja muy buena combinacion ajaja
pablo, 11 Años Antes
Gracias Pablo, bienvenido 🙂
QuimiTube, 11 Años Antes
Me a quedado quimica I en mi primer curso de ingienería industriales en la UPM… he encontrado esta pagina web y creo q ya se como m lo voy a preparar
Takeru, 11 Años Antes
¡Hola! Mucha suerte, espero de verdad que nuestros materiales te sirvan para sacar tu asignatura, ¡ánimo! Un saludo muy grande.
QuimiTube, 11 Años Antes
Desearía saber cómo predecir la polaridad de enlace a partir de la diferencia de electronegatividades. Ya que algunos dicen que si la Dif. E.N. es mayor o igual a 1,7 el enlace es iónico pero otros dicen que si es mayor a 1,8 y otros, mayor a 2. También, mencionan que si la Dif. E.N. es entre 0,5 a 1,7 es covalente polar pero otros dicen que es entre 0,4 a 1,7
Jorge Luis Torres, 11 Años Antes
Hola Jorge Luis, lo que ocurre es que no hay una forma precisa de predecir la polaridad a partir de la electronegatividad, por lo que hay diferentes criterios. Yo soy partidaria de utilizar el criterio del 1,7 porque surge de la fórmula empírica que determinó Linus Pauling. Puedes ver cómo se calcula el porcentaje de carácter iónico o covalente a partir de esta fórmula en este vídeo:
http://www.quimitube.com/videos/enlace-quimico-ejercicio-10-calculo-del-porcentaje-de-caracter-ionico-con-la-diferencia-de-electronegatividades/
QuimiTube, 11 Años Antes
Hola! te doy la enhorabuena por el blog. Se ve un inmenso trabajo realizado, por lo que no puedo pasar por alto el agradecerte tu tiempo y dedicación a tan elaborado material. Seguiré viendo mas vídeos porque sinceramente me parecen de lo mejor. Gracias!
angel, 11 Años Antes
Hola Ángel, mil gracias por tomarte tu tiempo para dejar este comentario, este tipo de apoyo es el que ayuda a continuar con el trabajo porque forma parte de sus recompensas. Un saludo muy grande.
QuimiTube, 11 Años Antes
buenas noches, estuve viendo los videos y estan muy buenos.
me gustaría consultarte si el momento dipolar de un enlace doble es igual al de un enlace simple?
consideras que el HNO3 es una molecula polar?
gracias desde argentina.
pablo, 11 Años Antes
Hola de nuevo! El video esta’ clarisimo muchas gracias por explicarlo todo siempre tan bien, es de gran ayuda. Solo tengo una duda: como se puede saber la geometria de una molecula? en tu video das ejemplos de lineal, trigonal, etc pero como podemos saberlo a priori?
Mil gracias
annalisa, 11 Años Antes
¡Hola! Hay diversas formas, pero están en vídeos posteriores. La forma más sencilla y habitual es la teoría de repulsión de pares electrónicos. Te enlazo aquí los vídeos que te resultarán de utilidad:
http://www.quimitube.com/videos/modelo-de-repulsion-de-los-pares-electronicos-de-la-capa-de-valencia-rpecv/
http://www.quimitube.com/videos/enlace-quimico-ejercicio-12-geometria-de-algunas-moleculas-por-rpecv-e-hibridacion-cs2-ocl2-ph3-chcl3/
¡Un saludo!
Quimitube, 11 Años Antes
Muy bien por estos videos tan didácticos y que los alumnos pueden utilizar con claridad. Ahora silas clases de química se aprenderan con entusiasmo. F elicitaciones por tu canal Quimitube. Saludos!! desde Perú.
Maria Curie, 11 Años Antes
¡Muchas gracias! Me gusta mucho dar clases, es algo muy agradable. Un saludo. P.D. Me gusta mucho tu seudónimo 🙂
QuimiTube, 11 Años Antes
Felicitaciones, explicaciones, precisas, entendibles y actualizadas, en quimica grl, inorganica y organica. Atte, Alberto Diaz, profesor de Quimica y Biologia, Cucuta, Colombia.
Jorge Alberto Diaz Fuentes, 11 Años Antes
Muchas gracias Alberto, es un honor este comentario viniendo de un docente. Un saludo.
QuimiTube, 11 Años Antes
Entre que tipos de átomos se da la unión? , muy buena las respuestas , me gusto mucho saber
Marisa, 10 Años Antes
Hola Marisa, el enlace covalente se da entre átomos no metálicos. En la tercera tabla periódica que encontrarás aquí:
http://www.quimitube.com/tablas-periodicas-pdf
Verás cuáles son los no metales de la tabla periódica que dan lugar a este enlace.
QuimiTube, 10 Años Antes
!Hola!
En primer lugar, unirme a la opinión unánime del resto de visitantes de la web. Los vídeos son excelentes y es una ayuda inmensa a tod@s los que estamos estudiando la química de 2ª bach. Una ayuda impagable. Me reitero, de 10. Por cierto, yo ya os sigo en FB 🙂
Yo tenía una duda, que seguramente ya estará desarrollada en otro apartado y, torpe de mí, no la encuentro (o peor aún, está explicada y no lo entiendo…).
Quiero saber determinar la polaridad o apolaridad de las moléculas. Entiendo el concepto de polaridad y su aplicación teórica en los enlaces y en la molécular, sin embargo, encuentro dificultades para, en la práctica, determinar la polaridad de moléculas.
Ej: BF3.
Molecular apolar
3 enlaces polares
¿Por qué aquí la suma de los 3 enlaces da 0 y la molécula se convierte en apolar? Tenemos 3 cargas iguales (las de «F») pero cada una con un vector diferente…¿cómo es posible que estos 3 enlaces polares se anulen por geometría?
Saludos, y disculpas por el «tocho»
JoseU, 10 Años Antes
Hola JoseU, mil gracias por tu comentario. Cuando tienes una molécula triangular plana, que es muy simétrica, estos vectores se anulan aunque a priori pueda parecernos que no. Te sugiero que dibujes la molécula bien grande en un papel milimetrado o cuadriculado y que cada vector del momento dipolar de cada enlace lo descompongas en sus componentes x e y. Una vez hecho esto, verás que se anulan. Otra forma de verlo es que pongas uno de los vectores sobre el eje y, y los otros dos formando 45º con ambos ejes. Si sumas estos dos que forman 45º, verás que te queda exactamente un vector igual al que está sobre el eje y pero en sentido contrario, -y, por lo que se anulan. No sé si se habrá entendido así la explicación, espero que sí. Un saludo grande.
QuimiTube, 10 Años Antes
¡Hola!
Sí, situando los vectores sobre el eje lo entiendo mucho mejor. Y efectivamente, se anulan los 2 de 45º. Gracias.
De cualquier modo, creo que es muy importante saber determinar la polaridad de las moléculas y me temo que no tengo suficiente «soltura» en este apartado…¿recomienda algún tema de repaso o profundización?
JoseU, 10 Años Antes
Hola, esta bien explicado, aunque sería mejor si explicaras como calcular la densidad de carga, que tengo entendido que es como el porcentaje de carga compartida que esta desplazada hacia el atomo mas electronegativo. Mi duda es: ¿ porque al tener sentido contrario se anulan los momentos dipolares?
gracias : )
Cristian, 10 Años Antes
Creí que no tenías comentarios teóricos de los vídeos, pero que bueno si lo tienes. Excelente explicando; saludos desde Costa Rica
José Rivera, 10 Años Antes
Hola José, gracias por tu comentario. Efectivamente tenemos parte teórica y parte de ejercicios, y en la parte teórica verás la explicación escrita a pie de vídeo por si prefieres leer en lugar de ver el vídeo. Un saludo grande.
QuimiTube, 9 Años Antes
hola tus videos son muy buenos… tengo una duda la polaridad de compuestos organicos la puedo dar por la diferencia de electronegatividades de las moleculas … o tambien la puedo dar por las fuerzas intermoleculares como dipolo-dipolo inducido…gracias 😀
DanielaGonzalez, 9 Años Antes
Tipo de uniones involucradas en una unidad elemental (molecula o unidad de formula)
BF3
K2O
SeO2
CuS
LiH
Ayudame por favor, gracias 🙂
Hola!, 9 Años Antes
Debes determinar la diferencia de electronegatividad entre los átomos y así verás si el enlace es iónico o covalente:
http://www.quimitube.com/videos/enlace-quimico-ejercicio-10-calculo-del-porcentaje-de-caracter-ionico-con-la-diferencia-de-electronegatividades
Como verás ahí, si la diferencia es mayor de 1,7 se considera enlace iónico, y si es menor se considera covalente.
QuimiTube, 9 Años Antes
Hola profe!como me doy cuenta q compuesto es mas polar q otro? Ppr ejemplo me dieron HCI, HF,HBr..no comprendo como averiguar eso..
yanny, 9 Años Antes
Hola Yanny, debes mirar la diferencia de electronegatividad entre los átomos. Cuanto mayor sea esta diferencia, más polar será el enlace. Te sugiero que vuelvas a ver el vídeo con detenimiento, ahí quedará mejor explicado. Un saludo.
QuimiTube, 9 Años Antes
Hola!! Genial su video!! Pero me encuentro frente a una duda: ¿Cómo podría saber la polaridad de una molécula sin tener a mano su estructura se Lewis? ¿Existe alguna posibilidad de saberlo sólo por su fórmula o necesariamente debo tener la estructura de Lewis? Saludos, ¡Gracias!
Diana, 9 Años Antes
Hola Diana, solo te sería posible si es una molécula diatómica, como HF o HCl, en la cual basta que miremos la diferencia de electronegatividad entre sus átomos para saber si será más o menos polar. Si tiene más átomos es necesaria la estructura de Lewis porque la polaridad global es la combinación de varios momentos dipolares, que son vectores, y por tanto su orientación es fundamental a la hora de establecer si se contrarrestan o se suman. Un saludo.
QuimiTube, 9 Años Antes
Por que la molécula de CH4 es apolar, se el carbono es mas eletronegativo que el hidrogéno?
maria, 9 Años Antes
Hola María, como decimos en el vídeo la polaridad molecular no depende solo de la polaridad de cada enlace sino de la geometría. La molécula de metano es tetraédrica y los momentos dipolares se anulan entre sí. Un saludo.
QuimiTube, 9 Años Antes
Porque existen moleculas que si bien sus enlaces son polares ellas no??
Madi, 9 Años Antes
Hola, eso es lo que explicamos en el vídeo, es una cuestión de geometría. Te aconsejo que lo veas con detenimiento y estudies la explicación a pie de vídeo. Un saludo.
QuimiTube, 9 Años Antes
Me ayudas muchisimo con tus videos, muchisimas gracias de verdad!!!!!
Gangre, 9 Años Antes
¡Gracias a ti por comentar!
QuimiTube, 8 Años Antes
Gracias por las explicaciones!!!! la verdad encantada! me estaba costando mucho retomar la parte química como introducción a una materia de medicina y con sus vídeos me ha salvado el coco! una Genia!!
Liliana marcela, 9 Años Antes
¡Muchas gracias Liliana y mucha suerte con tu materia!
QuimiTube, 9 Años Antes
¡Buenas tardes! No entiendo por que la molécula de BF3 es apolar. ¿Por qué ‘mu’ =0? Si la suma total de mu= mu-mu-mu, es distinto a 0 ¿no?
Muchas gracias por responder. Un saludo.
Ylenia, 8 Años Antes
¡Hola Ylenia! Es por su geometría, todas las moléculas que tienen la geometría trigonal plana son apolares porque se anulan entre sí aunque los enlaces sean polares, como te ocurre, por ejemplo, con un tetraedro. Si sumas dos de los vectores verás que te quedan del mismo módulo y dirección contraria al sentido del que queda, por lo que se anulan. Un saludo.
QuimiTube, 8 Años Antes
Una molécula que posee todos sus enlaces no polares ¿Puede ser polar?
Jaz, 5 Años Antes
¡Hola! No, en ese caso no podría ser polar, pero para que ningún enlace tenga ningún tipo de polaridad tienen que ser enlaces de átomos iguales, por lo que esta pregunta aplica en teoría pero a nivel práctico no hay ningún ejemplo más allá de las diatómicas, al menos que ahora se me ocurra.
QuimiTube, 4 Años Antes