Contenido del Vídeo
En este ejercicio resuelto de termodinámica química vamos a calcular la variación de entalpía de la reacción de fermentación de la glucosa, es decir, la reacción en la que la glucosa da lugar a dióxido de carbono y etanol (utilizada tradicionalmente y en la industria para la producción de bebidas alcohólicas). Para ello utilizaremos las entalpías de combustión de la glucosa y del etanol y aplicaremos la Ley de Hess.
El enunciado completo es el siguiente:
La reacción de fermentación de la glucosa, C6H12O6 (s), produce etanol, C2H5OH (l), y dióxido de carbono. Calcular la variación de entalpía de la reacción a partir de los datos siguientes:
ΔHco (glucosa) = -2813 kJ/mol
ΔHco (etanol) = -1367 kJ/mol
Las reacciones de combustión de la glucosa y del etanol que deberemos plantear son, respectivamente:
![]()
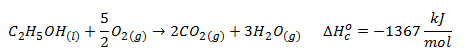
También te puede interesar:
Teoría:
Teoría Termoquímica 14: Cálculo de la entalpía de una reacción mediante la Ley de Hess
Ejercicios:
Ejercicio 29 Termoquímica: Cálculo de la entalpía de formación del óxido de zinc con Ley de Hess
Y también:
Todos los vídeos de teoría de termoquímica
Todos los vídeos de ejercicios de termoquímica
Category: Ejercicios de Termoquímica y Termodinámica Química.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Felicitaciones por los videos son excelentes los revisare y escuchare las clases con paciencia. Un abrazo hasta pronto
Dax Martel Mendoza, 11 Años Antes
Que lio macho en cada ejercicio el Etanol tiene una entalpia distinta, de -1380 y ahora de -1367, me gusta que las cosas sean fijas e inmutables y no cambien tanto, Saludos
Anónimo, 11 Años Antes
Hola «Anónimo», tienes razón, pero la mayoría de ejercicios son de selectividad y hemos optado por dejar los datos tal y como vienen en los enunciados de partida, y en esto no son fijos e inmutables, lamentablemente. Sin embargo, si dominas el procedimiento, no debería causarte tanta ansiedad. Saludos.
QuimiTube, 11 Años Antes
Lo siento mucho Carmen seguramente no sea para tanto, cuando algo se me mete en la cabeza tengo que comentar jeje, aparte estoy haciendo los ejercicios en papel por si me pudieran servir en un futuro y se hace pesado,como son tantos me agobie un poquito. Lo de Anónimo es que no me gusta mucho poner mi nombre públicamente pero soy el que le estuvo comentando acerca de las unidades del SI no se si se acordará de mi.
Bueno en fin, sólo me quedan dos apartados ácido-base y redox, espero que no se me haga tan duro como termoquímica, en cuanto a formulación inorgánica también tengo que ponerme un poquito al día ya que por lo visto los estados de oxidación también se ven en redox.
Un saludo desde Cádiz!!!!
Anónimo, 11 Años Antes
¡Hola! Sí, sí que me acuerdo, no pasa nada, los comentarios están para eso, para opinar; además siempre tengo en cuenta vuestras opiniones y sugerencias porque al fin y al cabo este contenido está hecho para los usuarios. Debe ser pesado hacer todos los ejercicios en papel, desde luego, pero creo que haces muy bien porque a la larga te merecerá la pena y te dará provecho tanto trabajo. Los vídeos de ácido-base y redox en general no tienen muy buena calidad, pero espero que te sigan sirviendo porque tardaremos un tiempo en regrabarlos. Mucho ánimo y no te agobies. Un saludo grande.
QuimiTube, 11 Años Antes
No se si me estoy volviendo un poco «majareta», pero el ajuste de la reacción de combustion del etanol esta mal (o eso creo, es la ultima ecuacion del problema). Ya que en los reactivos me salen 6 oxigenos y los productos 7. Espero que alguien arroje luz al asunto y me saque de esta disyuntiva.
PRJ, 10 Años Antes
Arrojo luz para darte la razón 🙂 No te estás volviendo majareta, ¡me equivoqué! Siento el tiempo que has perdido dándole vueltas, pero al menos sabes que estás bien preparado… Un saludo grande.
QuimiTube, 10 Años Antes
….. Muchas gracias…. Soy IQ y este video me va a servir, para solucionar un problema que tengo en la planta donde laboro….xD…
…Posdata… La Ciencia, es Hermosa….xD… Grax…!!!…
Keoh, 9 Años Antes
Me alegra mucho que te pueda servir para un proceso de tu planta, la ingeniería química también es muy interesante, me gusta mucho. Un saludo grande.
QuimiTube, 9 Años Antes
¡Buenas tardes Carmen! Ante todo darte las gracias por tus vídeos menos mal que di con ellos, me facilita mucho el estudio. En cuanto a este ejercicio tengo una pregunta, ¿la reacción de fermentación se podría ajustar de la siguiente manera?
1/2 C6H12O6 –> C2H5OH + CO2
Muchas gracias, un saludo!
Víctor
Víctor, 9 Años Antes
Hola Víctor, muchas gracias por tu comentario. Efectivamente podrías ajustarla de este modo. Un saludo.
QuimiTube, 9 Años Antes