Contenido del Vídeo
Este es el primer ejercicio en el que vamos a utilizar la Ley de Hess para calcular el valor de una entalpía de reacción, en concreto de la reacción de formación de etanol a partir de sus elementos en estado fundamental, es decir, carbono grafito, hidrógeno gaseoso y oxígeno gaseoso. En primer lugar debemos plantear dicha reacción de formación y, una vez planteada, veremos cómo podemos combinar las reacciones químicas aportadas en el enunciado (la reacción de combustión de etanol, la reacción de formación de dióxido de carbono y la de formación de agua) para lograr que por combinación de estas se obtenga la reacción objetivo. Una vez que hayamos determinado los coeficientes por los que es necesario multiplicar cada ecuación termoquímica para llegar a la ecuación problema, aplicaremos estos mismos coeficientes a los valores de entalpía para calcular la entalpía de formación del etanol.
El enunciado completo es el siguiente:
Usar la Ley de Hess para calcular la entalpía estándar de formación del etanol con los datos aportados:
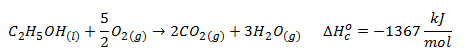
![]()
![]()
También te puede interesar:
Teoría:
Termoquímica Teoría 14: Ley de Hess para el cálculo de la entalpía de reacción. Aditividad de las entalpías.
Ejercicios:
Ejercicio 28 Termoquímica: Entalpía de fermentación de la glucosa mediante la Ley de Hess
Ejercicio 29 Termoquímica: Cálculo de la entalpía de formación del óxido de zinc con Ley de Hess
Y también:
Todos los vídeos de teoría de termoquímica
Todos los vídeos de ejercicios de termoquímica
Category: Ejercicios de Termoquímica y Termodinámica Química.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Hola Carmen!
Segun este anunciado:
Las entalpias de formacion del agua liquida y del dioxido de carbono gas son respectivamente, -286kJ/mol y -393kJ/mol y la entalpia de combustion del acetileno es -1299kJ/mol.
Calcule la entalpia de formacion del acetileno si consideramos que el agua formada en la combustion esta en estado liquido.
Haber yo resolvi este ejercicio por la ley de Hess pero el libro aplico directamente ∆Hr⁰=∆Hf⁰(product) – ∆Hf⁰ (reactiv) partiendo de los datos dados.
Por supuesto que los resultados no coinciden.
Estoy bien yo o el libro?
Gracias.
Sachet, 11 Años Antes
Ahora lo resolvi asi ∆Hr⁰=∆Hf⁰(product) – ∆Hf⁰ (reactiv) y el resultado me dio como el libro y tambien me di de cuenta que me comi un signo con la ley de Hess por eso no me daba lo mismo. jolineeess
Pero todavia me queda la duda si el metido que utilize primeramente es el mas correcto?
Gracias guapa!
Sachet, 11 Años Antes
[…] En este ejercicio resuelto de termodinámica vamos a calcular la entalpía de combustión del etanol mediante el uso de la denominada Ley de Hess. (No importa que haya llegado el verano, nosotros seguimos ampliando el material. […]
Cálculo de la entalpía de formaci..., 10 Años Antes
Tengo un ejercicio que tiene pide lo mismo , tiene todo exactamente igual menos lo de grafito. help!!
Jess, 9 Años Antes
¡Hola! ¿Te refieres a que en tu ejercicio no aparece la segunda reacción? ¿Solo las dos primeras? ¿O que tienes carbono pero no pone «grafito»? Si tienes carbono se hace exactamente igual, aunque no te hayan especificado que se trata de carbono grafito (lo darán por supuesto). Un saludo y ánimo.
QuimiTube, 9 Años Antes
Hola, me dieron tal ejercicio para calcular entalpía de reacción con la siguiente ecuación:
2CH3OH(liq) + 3O2(gas) –> 4H2O(liq) + 2CO2(gas) ∆Hr⁰=-1452,8Kj
¿Qué sucede si esa agua pasa de estado líquido a vapor?
Gisela, 9 Años Antes
Hola Gisela, si calculas la entalpía de la reacción con entalpías de formación, tendrás que tener en cuenta el valor de entalpía de formación para el agua líquida, tal y como aparece en la reacción (serán valores distintos para agua líquida y vapor). Puedes verlo en la tabla:
http://www.quimitube.com/wp-content/uploads/2013/04/Tabla-entalpias-estandar-formacion-compuestos-organicos-e-inorganicos.pdf
Si estuviese en estado gaseoso, entonces cambiarías el valor de la entalpía de formación que usarías en el cálculo.
Espero que se entienda.
Un saludo grande.
QuimiTube, 9 Años Antes
Genial! Estoy contenta porque por primera vez en no se cuantos años de estudiar Química he logrado entenderlo y saber hacer el ejercicio!
Mil gracias, es lo mínimo que puedo hacer, me estás ayudando muchísimo en todo Carmen! 🙂
Saludos.
Vanessa Maroto Juan, 8 Años Antes