Contenido del Vídeo
En este ejercicio determinaremos la estructura de Lewis de algunas moléculas covalentes sencillas, es decir, que no presentan resonancia y, por tanto, sólo se pueden representar con una única estructura de Lewis. Las moléculas son las siguientes: H2O, NH3, CO, H2S, N2, BF3, HCN, ICl3, PCl3, SF6 y BeCl2.
En aquellos casos en los que se cumpla la regla del octeto en el átomo central se aplicarán las siguientes reglas:
1) Determinar el número total de electrones de valencia de todos los átomos que forman parte de la molécula (A)
2) Determinar el número total de electrones de valencia que serían necesarios para que todos los átomos tengan su última capa completa. Para el hidrógeno contaremos 2 electrones y para el resto de átomos contaremos 8 (B)
3) Determinar el número total de electrones enlazantes, restando B-A = C
4) El resto de electrones de valencia de la molécula serán no enlazantes, por lo que si a estos, A, les restamos los enlazantes, C, obtendremos los electrones no enlazantes.
5) Una vez que sabemos los pares enlazantes y no enlazantes, colocaremos el átomo central rodeado de los átomos periféricos y pondremos los pares electrónicos de la forma adecuada para que cada átomo quede con su última capa completa.
Si tenemos átomos que incumplan la regla del octeto, tanto por defecto (boro, berilio) como por exceso (azufre, yodo, fósforo) no aplicaremos las normas de esta forma estricta, aunque sí que contaremos el número total de electrones de valencia para asegurar que colocamos la totalidad de los electrones reales en la estructura de Lewis final.
Asimismo, cabe destacar otras normas adicionales. Cuando se pueden proponer distintas fórmulas de Lewis para la misma molécula, se prefieren aquellas en las que las cargas formales de los átomos son cero. Si han de sustentar cargas formales, se prefieren las estructuras de Lewis en las que los átomos más electronegativos sustentan las cargas formales negativas; por último, las estructuras menos probables serán aquellas en las que cargas formales del mismo signo se hallen sustentadas por átomos adyacentes.
A continuación vemos dichas estructuras, aunque su determinación se explicará detalladamente en el vídeo:
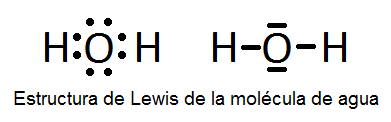
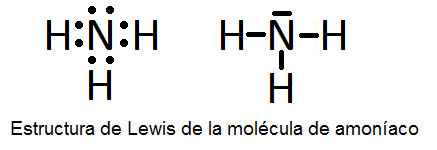

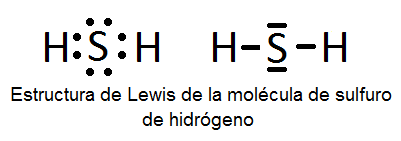
También puede interesarte:
Estructuras de Lewis de algunas moléculas con resonancia: O3, CO2, N2O, NO y NO2
Estructuras de Lewis de los oxoácidos del cloro
Estructuras de Lewis de aniones hipocloroso, nitrito, nitrato, sulfito, carbonato y sulfato
Estructuras de Lewis de algunas moléculas orgánicas: metanol, benceno, acetato, acetona y etanol
Category: Enlace Químico y Vídeos de Ejercicios de Enlace Químico.
Etiquetas: Enlace covalente y Estructuras de Lewis.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Gracias!
Dayana, 12 Años Antes
De nada, como siempre 🙂
Quimitube, 12 Años Antes
Hola! Cuando calculas el numero de pares enlazantes y no enlazantes, lo haces para que cumplan la regla del octeto, en el caso de no cumplirlo (se trate de un octeto expandido o incompleto), ¿como calculo el numero de electrones que debo asociarle a cada átomo? Gracias de antemano.
Sonia, 10 Años Antes
¡Hola Sonia! En ese caso el cálculo no es preciso, no te cuadrarán los pares enlazantes y no enlazantes por lo que es preferible saber de antemano que tienes un átomo central que suele incumplir (por ejemplo azufre o fósforo) y ampliar el octeto. Pero como te digo el método no es sistemático, sino más intuitivo.
QuimiTube, 10 Años Antes
el HCN tiene geometria lineal o trigonal plana?
Dayana, 12 Años Antes
HOLA… MUCHAS GRACIAS POR TOMARTE EL TIEMPO Y TRASMITIRNOS UN POCO DE TUS CONOCIMIENTOS, POR CIERTO ERES MUY GUAPA JEJEJE, DESDE AGUASCALIENTES MEXICO BESOS… 🙂
AXEL AARON, 11 Años Antes
¡Hola! Bienvenido. Gracias por comentar, los comentarios dan vida a la página 🙂 Un saludo grande
QuimiTube, 11 Años Antes
demaciado bueno
jose angel, 11 Años Antes
Gracias Jose Ángel y bienvenido 🙂
QuimiTube, 11 Años Antes
Hola! Me encanta tu página y me está siendo muy muy útil para preparar la selectividad. Tengo una duda en una estructura de Lewis, la del CO.
Parece lógico que deben existir tres pares enlazantes (triple enlace C-O), pero analizando las cargas formales, el O que es muy electronegativo quedaría con carga formal +1 y el C -1. En mi libro de texto aparece en un ejercicio un doble enlace C=O con dos pares electronicos libres en O y uno en C. Las cargas formales ahora si que son 0, pero no entiendo el motivo de esta excepción. Espero que puedas ayudarme!
Un saludo!
Alex, 11 Años Antes
¡Hola! Ya te he respondido en Facebook, pero la vuelvo a poner aquí por si otros usuarios la leen que se puedan aprovechar de la respuesta: Aunque resulte un tanto chocante que las cargas formales del CO sean las que comentas, y que por eso algunos libros planteen la estructura de Lewis con doble enlace, yo soy partidaria de escribirla con enlace triple (de hecho así lo hago en un ejercicio). Los motivos son dos: que con enlace triple el carbono cumple la regla del octeto (y la cumple siempre) y que se sabe que la distancia C-O en el monóxido de carbono es muy corta, es decir, más congruente con un enlace triple.
QuimiTube, 11 Años Antes
Gracias de veras¡¡ Me esta sirviendo mucho de cara a los finales 🙂
Pero tengo una duda: Como sabemos con quien debe enlazarse el Hidrogeno, por ejemplo el ácido cianhídrico HCN, ¿¿porque debe enlazarse con el carbono y no con el nitrogeno??
Victor, 11 Años Antes
¡Hola! Puedes plantear las dos estructuras de Lewis, lo que ocurre es que si planteas el hidrógeno unido al nitrógeno y este último como átomo central, te queda una carga formal de +1 sobre el nitrógeno y una de -1 sobre el carbono. Esto no es muy estable, porque tienes una carga formal positiva sobre el átomo más electropositivo de los dos. Cuando planteamos la estructura con el carbono como átomo central, entonces te queda carga formal cero tanto sobre el carbono como sobre el nitrógeno.
Espero que se comprenda.
¡Mucha suerte con tus finales!
QuimiTube, 11 Años Antes
Eres una crak!
Lauravg, 11 Años Antes
Jajaja, me parece que exageras un «pelín» 🙂 Un abrazo!
QuimiTube, 11 Años Antes
Una pregunta por que en el ultimo ejemplo el Be no puede formar un doble enlace con los Cl, y asi poder cumplir la regla del octeto?
Laura, 11 Años Antes
Hola Laura, no puede formar doble enlace porque los átomos de cloro sólo tienen un electrón desapareado. Esto hace que sea totalmente imposible para un cloro formar dos enlaces, si fuese así tendría más de 8 electrones en su última capa.
QuimiTube, 11 Años Antes
Hola, antes de nada mi enhorabuena por el magnífico trabajo que realizas.
Me gustaría saber como pondrías tu la estructura de Lewis para el CO con doble enlace y en el caso del triple enlace, si el oxígeno cede un electron al carbono no estaríamos ante un enlace dativo covalente??
Jose Ramon, 11 Años Antes
Gracias por los vídeos, están comprensibles…
Ronald, 11 Años Antes
es de mucha ayuda
suy melissa rodriguez, 11 Años Antes
muchisimas gracias por el aporte! mucho mas sencillo que la forma que me habian enseñado en la facultad 😀 son geniales tus videos!
Belen, 11 Años Antes
todo muy bien explicado 😉
silvia, 11 Años Antes
Hola! No entiendo como sacas el segundo paso (nº de electrones necesarios).
Muy buenos tus videos.
Un saludo.
Irene, 11 Años Antes
¡Hola! Los calculamos considerando que todos los átomos cumpliesen la regla del octeto. Así, cada uno necesitará 8 electrones para completar la última capa, por lo que multiplicamos el número de átomos por 8. Si hay algún hidrógeno, a este solo le cuentas 2 porque le bastan 2 electrones para completar la última capa. Espero que estoy te aclare la idea. Un saludo.
QuimiTube, 11 Años Antes
Tengo una duda en el BeCl2: Si tenemos 16 electrones disponibles (2 del Be y 14 del Cl2) y 24 electrones necesarios, al final quedan 8 electrones compartidos que formarían 4 enlaces y 8 electrones sin compartir. ¿No?
Gracias por la página 🙂
Tamara, 11 Años Antes
¡Hola Tamara! Lo que ocurre es que el berilio es una de las excepciones, te recomiendo el vídeo siguiente:
http://www.quimitube.com/videos/enlace-covalente-excepciones-a-la-regla-del-octeto/
QuimiTube, 11 Años Antes
una pregunta porque el H2O lo pone lineal no es tetraedro porfavor ayudame.
EXITOS !! 😉
shirley, 10 Años Antes
¡Hola! Las estructuras de Lewis no dan información sobre geometría, hay que aplicar después otras teorías para llegar a la geometría molecular. En efecto la molécula de agua no es lineal, sino angular (puedes ver este vídeo sobre hibridación sp3 del agua) pero cuando hacemos la estructura de Lewis simplemente obviamos la geometría porque no podemos saberla. Un saludo.
QuimiTube, 10 Años Antes
muchas gracias este vídeo me a ayudado a aclarar muchas dudas te agradezco es una excelente profesora
camila torres, 10 Años Antes
¡Muchas gracias Camila!
QuimiTube, 10 Años Antes
Hola! no comprendo por qué si la configuración del O es 1s2, 2s2, 2p4, por qué necesita OCHO electrones? gracias^^
Ángela, 10 Años Antes
¡Hola! Los 8 electrones que necesita son en el nivel 2, es decir, si tú miras solo el último nivel 2s2 2p4, ahí tienes solo 6 electrones. Por este motivo te faltan 2 para que el nivel 2 esté completo, 2s2 2p6 (caben 2 electrones en los orbitales s y 6 electrones en los p).
QuimiTube, 10 Años Antes
Mira dice asi las sguientes sustancias contienen enlaces covalentes multiples. Elabora la estructura de lewis. Para cada una HCN SO3 HNO3 SO2 O3
wendy carrillo, 10 Años Antes
¡Hola! La idea es que veas el vídeo y que intentes hacerlo por ti misma. Hay más vídeos y creo que todas las sustancias que indicas están en ellos. Un saludo.
QuimiTube, 10 Años Antes
hola! una consulta, no entiendo porque cada hidrógeno necesita 2 electrones, me puede explicar por favor? 🙂
vanessa, 10 Años Antes
¡Hola! Cada átomo necesita llenar su último nivel para estar completo. En el caso del hidrógeno su último nivel es el 1, que solo tiene un orbital s. En un orbital s caben solo 2 electrones y estos son los que el hidrógeno necesita llenar para estar completo. Espero que se comprenda. Un saludo.
QuimiTube, 10 Años Antes
Muy bien explicado, Gracias. Dios le bendiga.
Alejandro Elbi, 10 Años Antes
Mil gracias a ti por tu comentario.
QuimiTube, 10 Años Antes
Excelente página para todos los amantes de la química, o para todos aquellos que están llevando esta asignatura en el colegio o universidad.
J-Sequeiros, 10 Años Antes
Muchísimas gracias por tu comentario y bienvenido.
QuimiTube, 10 Años Antes
Hola, en la estructura de Lewis del CO, el C tiene 4 electrones en su capa de valencia, y por lo que tu pones que hace tres enlaces con el O y entonces utiliza 3 electrones por lo que le sobra 1, entonces no pueden quedarle 2 electrones más sin compartir, no es así?
Rocio, 10 Años Antes
Hola Rocío, sí que podemos plantearlo de este modo porque cogemos todos los electrones como un conjunto global de la molécula, lo que ocurre es que te quedará el carbono con una carga formal de -1, pero esto no es erróneo.
QuimiTube, 10 Años Antes
son grandiosos en esto
josue, 10 Años Antes
¡Muchas gracias!
QuimiTube, 10 Años Antes
Hola, el en lace de la molécula de CO es dativo, o de dónde sale el electrón para que el carbono complete su capa de valencia? Gracias. Excelente pagina
ingrid, 9 Años Antes
¡Hola! Fíjate que lo que hacemos es un conteo global de electrones y luego los redistribuimos. Tienes 10 electrones, por lo que tienes que tener 5 pares electrónicos, 3 enlazantes y 2 libres. Los electrones de una molécula son realmente indistinguibles (se forman orbitales moleculares, los electrones pertenecen a la totalidad de la molécula). No es necesario plantear un enlace dativo para que la estructura de Lewis sea correcta.
QuimiTube, 9 Años Antes
Hola!
¿Quiere decir que tenemos que tener cuidado con el Boro, Fosforo, Yodo, Berilio y Azufre al momento de hacer su configuración de Lewis?
Muy buen video, genial. Te haces comprender en tu explicaciones!
Jimmy, 9 Años Antes
Hola, efectivamente son elementos con los que tener cuidado por sus posibles excepciones, hay que contemplar más posibilidades con ellos. Un saludo grande y gracias por tu comentario.
QuimiTube, 9 Años Antes
Gran Trabajo, felicitaciones por la paciencia y la gran vocación para enseñar.
Igni, 9 Años Antes
¡Muchas gracias! Un saludo grande.
QuimiTube, 9 Años Antes
Hola!
Excelente video, lo haces muy bien. pero la verdad no entendi nada…de seguro la quimica no es lo mio!
Aproposito quien es lewis?
amparo, 8 Años Antes
¡Hola! Este químico de aquí https://es.wikipedia.org/wiki/Gilbert_N._Lewis
QuimiTube, 8 Años Antes
Hola Ikima 😛
Muy bien por tu web 😉
Tengo una duda respecto al CO. Entiendo hasta el doble enlace, pues son enlaces covalentes en donde el oxígeno queda con 8 electrones de valencia y el carbono con 6. Pero no entiendo cómo se forma el tercer triple enlace si el oxígeno tiene completa su capa de valencia. Lo que ¨veo¨ es que el oxígeno cede/comparte dos electrones con el carbono pero no se por qué ocurre.
Un saludo :*
Ricardo, 7 Años Antes