Contenido del Vídeo
Calcularemos el pH de una disolución 0,05 M de ácido acético, es decir, un ácido débil, sabiendo el valor de su constante de acidez, Ka = 1,79·10^(-5). Recordemos que un ácido débil no se halla totalmente disociado en agua, sino que se establece un equilibrio ácido base, es decir, entre la forma molecular del ácido y la forma desprotonada (su base conjugada). En este caso, se establece un equilibrio entre el ácido acético y el acetato que podemos ver a continuación:
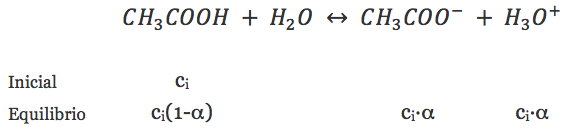
Como vemos en el equilibrio, de la concentración inicial, ci, que tengamos de ácido (en este caso 0,5M) una cierta cantidad se disociará, lo cual depende del valor de α o grado de disociación del ácido. De este valor de α también dependerá la concentración de iones oxonio final, lo que nos permitirá determinar el pH.
Así, establecemos un valor de constante de acidez, que no es más que una constante de equilibrio levemente modificada (se incluye en ella la concentración de agua). Por tanto, plantearemos el equilibrio químico, cuyo objetivo es calcular la concentración de iones oxonio en el equilibrio ([H3O+]) y poder calcular pH = -log[H3O+]. Si tienes dudas sobre los conceptos consulta la Teoría ácido base 3: concepto de pH y la Teoría ácido base 4: fortaleza de ácidos y bases.
El enunciado completo es:
Calcular el pH de una disolución 0,05M de ácido acético, sabiendo que su constante de acidez es 1,79·10-5.
Category: Ejercicios resueltos ácido base y Vídeos Ácido base.
Etiquetas: Ácidos y bases débiles, Cálculos de pH y pOH y Constantes de acidez y basicidad.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Ese tipo de temas son muy importante saberlos. Gracias por tu gran esfuerzo y dedicacion!
Zaito Hiraga, 13 Años Antes
Yo también opino que es muy importante divulgar la química, por eso me gusta dedicarle tiempo a transmitir lo que puedo 🙂 Gracias a ti, por tu comentario, ¡y bienvenido!
Quimitube, 13 Años Antes
Jejeje si, se nota la pasion en tus videos : D, ¡que tengas mucho exito!
Zaito Hiraga, 13 Años Antes
gracias, te entendi en 8:45 min lo que no pude hacer en dos clases en la u
wilson ortiz, 12 Años Antes
Me alegro de que se entienda 🙂 Gracias por comentar y bienvenido.
QuimiTube, 12 Años Antes
lo máximo (Y)
guillermo, 11 Años Antes
Gracias Guillermo 🙂
QuimiTube, 11 Años Antes
gracias por los videos, son de gran ayuda. Entiendo todo ahora !
Maria José Pereira Ortíz, 12 Años Antes
Muchísimas gracias Maria José y bienvenida. Si tiene alguna duda puedes consultarnos cuando quieras.
Un saludo,
Carmen
QuimiTube, 12 Años Antes
muchisimas gracias ,lo necesitaba ,por que se me viene un examen importante ,y bueno ahora ya se como resolverlo ,bendiciones
alexis jesus, 12 Años Antes
No hay de qué, gracias a ti por comentar. Me alegro mucho de que te sean de ayuda, mucha suerte con tu examen.
Un saludo y bienvenido,
Carmen
QuimiTube, 12 Años Antes
Excelentemente bien los vídeos
Felicitaciones
Alfredo Muñoz, 12 Años Antes
Muchísimas gracias, Alfredo, y bienvenido. Lamento mucho que los de pH no tengan la calidad de imagen que los vídeos actuales, pero espero que aún así sigan siendo útiles. Un saludo.
QuimiTube, 12 Años Antes
Ademas de ser muy bella explica muy bien, felicitaciones ecuación perfecta!
Carlos Ariza, 12 Años Antes
explicas mejor que mi maestra…
eva, 12 Años Antes
Jajaja, gracias Eva, seré tu maestra virtual 🙂
QuimiTube, 12 Años Antes
De verdad te agradezco por tu tiempo.. se me viene un examen y ahora ya entiendo! de verdad gracias, muchas gracias!
Lisseth, 12 Años Antes
Hola Lisseth, me alegro muchísimo de que te sirva y espero que me digas qué tal te fue tu examen. ¡Muchísima suerte!
QuimiTube, 12 Años Antes
Ei, una cosa, he probado el problema por la alfa, y no hay manera de que me de el mismo resultado que a ti, y si no me equivoco debería darme lo mismo!
P.D. Gracias a ti saque un 7 en el examen de Equilibrio químico! haha
Andra, 12 Años Antes
¡Hola! En cuanto pueda le echo un vistazo al ejercicio y te comento dónde puede estar el fallo, ¿has revisado bien los cálculos?
Enhorabuena por ese 7 de equilibrio químico, es fenomenal 😀 Un saludo grande
QuimiTube, 12 Años Antes
Hola.
Hace tiempo que se escribió este comentario y supongo que la respuesta llega un poco tarde; pero creo que para los alumnos que estén viendo esta página, puede servirles de ayuda.
Comentaba que no le daba el mismo resultado haciendo el equilibrio mediante la x que por alfa (grado de disociación), pues bien, vamos a verlo.
Establecemos la tabla de equilibrio químico. Permitirme poner el ácido de forma genérica como AH y el anión como A- (para abreviar) y que alfa lo ponga como & (mi pc no me deja poner el símbolo). Tenemos lo siguiente:
AH + H2O —-> A- + H3O+
Concentración inicial 0,05 / /
Durante la reacción – 0,05·& 0,05·& 0,05·&
Equilibrio Químico 0,05·(1-&) 0,05·& 0,05·&
Ahora, teniendo en cuenta la expresión de la constante de acidez:
Ka = ([A- ]•[H3O+]) / [AH] =(0,05•&•0,05•&) / (0,05•(1-&))≅0,05•&^2
Hemos simplificado un 0,05 puesto que está tanto en el numerador como en el denominar y hemos hecho la aproximación de 1-& ≅ 1 ya que la constante de acidez es muy pequeña (ácido débil). Ésto siempre lo podremos hacer cuando la constante de acidez sea menor a 10^-5 (10^-5, 10^-6…).
Esta aproximación lo único que nos está diciendo, es que el grado de disociación (tanto por cierto de la concentración inicial de reactivos que se ha transformado en productos) es muy pequeño, la reacción apenas ha transcurrido hacia la formación de productos y frente al 1, se puede despreciar.
Bien, como tenemos el valor de Ka = 1,77·10^-5, lo único que nos queda es despejar el valor del grado de disociación:
1,77·10^-5=0,05•&^2 ——> &=√( (1,77•10^-5)/0,05)=0,0188
Ahora, usando la expresión del pH = -log (H3O+), donde tenemos que tomar el valor de la concentración de protones en el equilibrio, llegamos a:
pH = -log (H3O+) = -log (0,0188·0,05) = 3,026
A la profe, le daba un valor de 3,025. Creo que es bastante aproximado, no? 😉
Un saludo.
Ayla, 11 Años Antes
Hola muy buenas, sigo haciendo los ejercicios que pones aquí, y tengo una duda, en este problema si se obtiene la concentración usando el grado de disociación…se podría simplificar a la hora de hallar el Ka, puesto que la concentración inicial x (1-alfa) se simplificaría a 1 y no habría que hacer la ecuación de segundo grado. Yo lo he hecho así y me sale el resultado igual, pH = 3,025
. Muchas gracias
Gonzalo, 12 Años Antes
Hola Gonzalo, sí, en realidad en el ejercicio también hemos despreciado valores, lo que ocurre que los hemos despreciado al final, pero en verdad tampoco hemos resuelto la ecuación de segundo grado completa. Tu resultado es correcto.
QuimiTube, 12 Años Antes
Muchísimas gracias por subir este vídeo. Me sirvió para entender este tipo de ejercicios. Saludos desde Uruguay
Yoseline Lagorio, 11 Años Antes
Gracias a ti por comentarlo Yoseline, me alegro mucho de que te haya servido. Un saludo hasta Uruguay.
QuimiTube, 11 Años Antes
No entiendo de donde salieron los 8,95 desde alli hacia abajo no entrndi:(
Josefa, 11 Años Antes
Hola Josefa, tienes que 1,79·10^(-5)*(0,05-x) = x2
Si ahora multiplicas para eliminar el paréntesis, 1,79·10^(-5)*0,05 – 1,79*10^(-5)x = x2
Cuando multiplicas 1,79·10^(-5)*0,05 te da 8,95, y de ahí continuás con la ecuación. Ya no es una cuestión química, sino matemática.
QuimiTube, 11 Años Antes
hola , gracias por tus videos mi pregunta es como sabes cuando un acido es débil o fuerte
julissa, 11 Años Antes
¡Hola! Te recomiendo que leas esta entrada del blog:
http://www.quimitube.com/algunos-acidos-y-bases-fuertes-de-uso-comun/
QuimiTube, 11 Años Antes
Muy bueno, aunque me quedé con la duda cuando estabas sacando los posibles valores de X tras la EC. Cuadrática, porque tachas el (-1,79 *10 a la -5) ¿?
Saludos
Matías Jara Flores, 11 Años Antes
¡Hola Matías! Los taché porque realmente es un valor que comparado con el otro sumando es prácticamente despreciable, de modo que lo puedes despreciar por simplificar. Pero también puedes hacer la ecuación completa sin despreciar ningún sumando, no pasaría nada. Un saludo grande.
QuimiTube, 11 Años Antes
Hola!
No suelo comentar en webs y tal, pero en este caso debo hacer una excepción… muchísimas gracias por hacerlo tan fácil, llevaba dos semanas de PH sin enterarme de papa, pero gracias a ti eso ha cambiado…
Te mereces un monumento!
Nico, 11 Años Antes
¡Hola Nico! Guau, muchas gracias por tu comentario 😀 Me alegro de que hayas hecho una excepción para comentar, y sobretodo me alegro de que empiezas a entender el tema de ácido base. Un saludo muy grande y bienvenido.
QuimiTube, 11 Años Antes
x q no se desprecia el x?
yudyt, 11 Años Antes
¡Hola! A veces podemos despreciar algunos valores, pero en este caso despreciar x sería un tanto excesivo, además es lo que pretendes calcular…
QuimiTube, 11 Años Antes
hola… Entiendo el ejercicio, lo resolvi d una manera similar; solo q desprecie la x del denominador de la ecuacion de la constante (0.05 – x) y la concentracion del acido la dvidi al K a como este resultado me da mayor q 100 calcule la concentracion de iones hidroneo como la raiz cuadrada de la concentracion inicial del acido y la constante.. Luego resolvi el ph. La pregunta e q diferencia hay entre tu procedimiento y el mio…?? Saludos
johana, 11 Años Antes
¡Hola! Mi procedimiento es el más formal, luego hay diferentes aproximaciones para resolverlo. Las aproximaciones siempre introducen cierto error, la cuestión es si ese error es o no es asumible. Normalmente introducen un error pequeño, ¿qué pH has obtenido tú?
QuimiTube, 11 Años Antes
hola una duda por que en la ecuación cambias los signos? si tanto la constante x como el 8.. siguen en la misma posición ?
naya, 11 Años Antes
¡Hola! No siguen en la misma posición, los hemos pasado restando al lado contrario, pero después hemos escrito la ecuación al revés para no empezar por el 0, es decir: x^2 + 1,79·10^-5x – 8,95·10^-7.
QuimiTube, 11 Años Antes
no es mas facil dividir la molaridad /con el Ka y si es mayor a mil hacer la siguiente ecuacion:
raiz de : 1,79×10-5 x 0,05 y listo..
naya, 11 Años Antes
Hola Naya, si a ti te va bien de ese modo no hay problema. Yo no lo hago porque se trata de que los alumnos vean en profundidad el fundamento químico del cálculo, y al aplicar una fórmula memorizada considero que esto se pierde. Un saludo.
QuimiTube, 11 Años Antes
Hola tengo una duda, al sacar el X a mi me enseñaron que tengo que sacar el % y si esta es mayor a %5 la concentración de X no se desprecia y yo tengo que hacer un calculo,donde tengo que hacer formulas matematicas, la pregunta es; al hacer mi ejercicio matemático, que tengo que tomar en cuanta ¿ los moles iniciales o la concentración que me da de X ?
cami, 11 Años Antes
Hola Cami, ¿te refieres al hacer el cálculo del pH? Para calcular el pH tienes que tener en cuenta el valor de x que obtienes tras la ecuación, no la concentración inicial.
QuimiTube, 11 Años Antes
por que no se desprecio x en la parte donde sale 1,79×10 a la -5 =x-x sobre005-x…. cuando despreciar la x pa no hacer la ecuacion cuadratica???
crc, 11 Años Antes
¡Hola! Lo cierto es que el tema de despreciar la x no está estandarizado, algunos profesores tienen una opinión y otros otra. Yo suelo despreciarla sólo cuando es muy evidente que hacerlo no cambiará el resultado, pero cuando la concentración inicial es de 0,05, por ejemplo, es un poco arriesgado.
QuimiTube, 11 Años Antes
Sos excelente, es mi noche antes del examen y tus videos me estan ayudando muchisimo.
Gracias!!!! Genia!
Daniela, 11 Años Antes
Ánimo Daniela, ¡muchísima suerte con tu examen!
QuimiTube, 11 Años Antes
de verdad son muy buenos tus videos, y he entendido muchisimo, manana tendre examen de equilibrio quimico y equilibrio ionico, pero aun no logro entender como sacas los resultados de la formula de la resolvente para las escuaciones de segundo grado, las hago pero jamas coincido con tus resultados, no se la razon, intento resolverla como aprendi desde hace a#os y no coincido con tu resultado, espero puedas aclarar mi duda, gracias!!
steven, 11 Años Antes
Hola Steven, bienvenido. Pues en verdad no sé dónde puede estar el problema, ¿qué fórmula estás empleando?
QuimiTube, 11 Años Antes
la misma que usted usa, la formula de la resolvente, pero en ese problema.. no me da igual que a usted el resultado de . la raiz cuadrada de -4(1)(-8,95×10-7)..
steven, 11 Años Antes
la misma que usted usa, la formula de la resolvente, pero en ese problema.. no me da igual que a usted el resultado de . la raiz cuadrada de -4(1)(-8,95×10-7)..
steven, 11 Años Antes
¿Será que yo he despreciado algún valor y tú no? Lo siento, es que no he podido mirarlo en profundidad…
QuimiTube, 11 Años Antes
Hola, muy buen video, iba todo perfecto hasta que llegamos a la ecuación de segundo grado, no entendí de donde sale el numero 1, y porque eliminaste »b» al cuadrado con »b» , en resumen toda la ecuación de segundo grado no la entendí… gracias.
mauricio, 11 Años Antes
Hola Mauricio, bienvenido. Hemos hecho una simplificación, ya que al ser el valor de la constante muy pequeño, cuando lo elevas al cuadrado es todavía más pequeño y te queda un valor del orden de 10^(-10), es decir, en torno a 0,0000000001. Por eso hemos despreciado este valor, que no tendrá efecto en el resultado final del pH. Sin embargo, si esto te confunde, no hay problema con que hagas la ecuación de segundo grado completa, con todos los factores, sin meterte en consideraciones matemáticas o de simpliclidad. Te recomiendo que hagas por ti mismo la ecuación, con el método que prefieras, y luego compruebes si obtienes el mismo resultado de pH final. Un saludo y gracias por comentar.
QuimiTube, 11 Años Antes
Hola buenas tardes,
Una duda, se supone que el ion acetato proviene de un ácido débil, siendo una base conjugada fuerte y por lo tanto al ser fuerte reaccionara con el agua de la misma disolución liberando iones OH^- esta reacción no afectara el pH de la disolución ?? ya que estas resolviendo el ejercicio en base a la primera disociación.
Agradecería me corrigieras si estoy equivocado.
ivan jaramillo, 11 Años Antes
Hola Iván, cuando se dice que la base conjugada procedente de un ácido débil es una base fuerte es una aproximación que se hace, pero realmente no es muy adecuada. El motivo es que el producto de la constante de un ácido y la de su base conjugada debe dar 10^(-14) (producto iónico del agua), de modo que si la constante del ácido acético es del orden de 10^(-5), la de su base conjugada, el acetato, es del orden de 10^(-8). Por tanto, la realidad es que el acetato como base es muchísimo más débil que el acético como ácido. Además, nosotros planteamos un equilibrio en el cual intervienen ambas especies y solo de esto dependerá el pH. Un saludo.
QuimiTube, 11 Años Antes
Hola, solo quería agradecerte infinitamente por tus videotutoriales, de verdad que en mi graduación los mencionaré 😀
Camila Natib, 11 Años Antes
Hola Camila, me alegra que te sirvan tanto 🙂 No hace falta que los menciones (con tu comentario me animas mucho el día) pero si lo haces tendrás que pasarme un vídeo para darte la enhorabuena jeje. Un saludo muy grande.
QuimiTube, 11 Años Antes
Hola! muchas gracias por tus vídeos. Tengo una duda, como diferencio una base fuerte de una débil, o un ácido fuerte de uno débil? te agradezco de ante,antemano tu ayuda!
maria, 11 Años Antes
¡Hola María! En general haciendo ejercicios más o menos sabrás cuáles son fuertes y cuáles débiles, porque casi siempre se usan los mismos. No obstante, debes saber que la constante de un ácido o base fuerte es prácticamente infinita, por lo que si en un ejercicio en el que te piden calcular un pH no te dan valor de la constante es porque el ácido o base en cuestión es fuerte y se disocia totalmente. Si por el contrario te dan el valor de una constante, es porque no se disocia por completo y lo tendrás que tratar como un ácido débil, planteando el equilibrio químico tal y como hacemos en este ejercicio con el acético. Te dejo además una pequeña entrada del blog sobre el asunto: http://www.quimitube.com/algunos-acidos-y-bases-fuertes-de-uso-comun/
Asimismo, te enlazo a la tabla de constantes de acidez y basicidad en pdf que te puede servir para consulta. Los ácidos están colocados de más fuerte a menos (cuanto más pequeña es su constante, más débil es el ácido).
http://www.quimitube.com/wp-content/uploads/2012/03/Tabla-de-Ka-y-Kb.pdf
¡Un saludo!
QuimiTube, 11 Años Antes
Hola Mi nombre es Aye y me gustó mucho el video, me ayudó mucho, pero como resuelvo un ejercicio donde me dan el ph del acido debil y lo que tengo que averiguar es la concentracion inicial.
Ayelén Ricardo, 11 Años Antes
¡Hola! En ese caso pondrás la tabla del mismo modo, lo que ocurre es que la [H3O+] ya la tienes, porque te dan el pH y sabes que pH = -log[H3O+]. Una vez que determinas esta concentración, que será igual a c·alfa (concentración inicial del ácido por grado de disociación si tienes un ácido monoprótico) entonces podrás despejar la concentración inicial si conoces alfa. Es decir, [H3O+] = c del ácido · alfa. Espero que se comprenda. Un saludo.
QuimiTube, 11 Años Antes
Hola.. Primero te quiero dar las gracias por los videos 😉 y lo segundo es que te quería preguntar ¿ cuándo la Ka/ Kb = c * (alfa) ^2 se puede despreciar?
Karen, 11 Años Antes
¡Hola! En ocasiones se utiliza esa fórmula, aunque la verdad es que yo lo suelo despreciar un poco más grosso modo, sin detallar, o directamente no desprecio nada. Un saludo grande.
QuimiTube, 11 Años Antes
Hola. Tengo la siguiente duda en un ejercicio en el que me piden el grado d disociación de una ácido y me dan el volumen y la masa(concentración) y el valor d Ka. Saco el grado d disociación d Ka ,despreciánd alfa en el denominador. Con lo qe me queda que alfa=√(Ka/co). Hasta allí bien. Pero para llegar a esta igualdad he tenido que despreciar alfa dl denoninador de Ka. Y al final me da que alfa es igual a 0,0227. ¿No estaría mal despreciado este valor? Yo creo que sí, pero según las soluciones que nos dió el profesor , así está bien el ejercicio. Gracias de antemano.
javier, 11 Años Antes
Gracias por ayudar a los que estudiamos esta rama!!!! me salvo!!! quisiera subscribirme a su pagina de videos.Donde puedo hacerlo???
Génesis Usca, 10 Años Antes
¡Hola! Gracias por tu comentario 🙂 No tenemos suscripción a quimitube, pero sí puedes suscribirte al canal de youtube si lo que quieres es estar enterado cuando subamos un vídeo nuevo. Arriba a la derecha tienes el icono de youtube y ahí podrás suscribirte. Un saludo.
QuimiTube, 10 Años Antes
Hola!, tengo una duda, cuando no me dan la molaridad, es decir, solo tengo la constante de equilibrio, y el porcentaje de disolucion del acido, como calculo el pH?
libia, 10 Años Antes
¡Hola! Planteas esto:
[HA] inicial = C
[HA] equilibrio = C(1-alfa)
[A-] equilibrio = C·alfa
[H3O+] = C·alfa
Planteas la expresión de Ka y tu única incógnita será la concentración inicial de ácido, C. Cuando la calcules, tendrás C·alfa, que es igual a [H3O+] y podrás determinar el pH.
QuimiTube, 10 Años Antes
Hola, me encanto esta pag. Pero tengo una duda, en la raiz donde sale ….
Raiz de (1,79×10^-5)^2_4×1(-8,95×10^-2)
Todo eso divido en 2
Como te salio este resultado
0,00189 no me puede dar, disculpa.
Si me lo pudieras aclarar
Gracias
Cristina, 10 Años Antes
¡Hola! Surge de aplicar la fórmula de la ecuación de segundo grado, -b(+/-)Raíz(b^2 – 4·a·c) / 2·a (espero que se entienda así escrita). En tu caso, b es 1,79·10^(-5) y a·c es -8,95·10^-2.
QuimiTube, 10 Años Antes
con referente a la pregunta de cristina sigo con esa duda, de como llegaste a tal resultado :/ entiendo la formula de la ecuacion pero no logro llegar al resultado, te agradeceria mucho que me lo explicaras.
gracias 🙂
camila, 9 Años Antes
¡Hola! Lo que ocurre es que despreciamos dentro de la raíz el (1,78·10^-5)^2 por ser un valor muy pequeñito, (te queda del orden de 10^-10) y por eso no lo usamos. Pero si quieres lo puedes poner y te dará prácticamente lo mismo y a lo mejor te confunde menos.
QuimiTube, 9 Años Antes
Buenísima me salvaste, la verdad me has salvado más de una vez con tus videos saludos y graciass
Camila, 10 Años Antes
¡Hola! Gracias a ti por dejar un comentario. Un saludo grande.
QuimiTube, 10 Años Antes
Muchas gracias por todos estos vídeos y ayuda, me han servido mucho, aparte es mucho más ameno cuando lo explica una chica tan guapa jaja
Rama7, 10 Años Antes
¡Muchas gracias! Un saludo.
QuimiTube, 10 Años Antes
Hola muy buen video ! solo me queda una duda de cuando se desprecian los valores :/ el resto todo bien 😀 he aprendido bastante para mi prueba que se me acerca :3
Gracias x los videos saludos :))
Daniel, 10 Años Antes
¡Hola Muchas gracias por tu comentario. No te preocupes por lo de despreciar, en realidad no es necesario. Algunos profesores dan fórmulas para despreciar en base al valor de Ka o Kb, pero al final es una fórmula más que aprender en tu cabeza cuando solo se trata de resolver una ecuación matemática. Un saludo.
QuimiTube, 10 Años Antes
amiga mira voy hacer una critica pero constructiva nada de ser criticon … mira es que aveces escribes y no dices los valores para nosotros rectificar y estar satisfechos trata de mejorar eso ( hablar mas sobre lo que estas haciendo ) para que entendamos mucho mas rapido pero de resto biien graciias por tu tiempo me has ayudado mucho te felicito haces un muy buen trabajo
david, 10 Años Antes
Hola David, gracias por tu crítica constructiva, voy rectificando eso para posteriores vídeos. Un saludo grande.
QuimiTube, 10 Años Antes
me gustaría saber, de donde puedo sacar cada valor de los compuestos, podrías explicitarlo, saludos me han sido de mucha ayuda sus vídeos.
jose antonio aguilar, 10 Años Antes
Hola José Antonio, ¿te refieres a los valores de Ka? Aquí tienes una tabla:
http://www.quimitube.com/wp-content/uploads/2012/03/Tabla-de-Ka-y-Kb.pdf
QuimiTube, 10 Años Antes
Hola! Tengo una duda: Haciendo este tipo de ejercicios en clase, mi profesora solía utilizar la técnica de aproximación que como ya sabrás, sólo se puede utilizar si el valor de la división entre la concentración inicial y Ka es igual o mayor que 100. En este caso si lo es, lo que quiere decir que la X es tan pequeña que se puede despreciar, y así quedarnos con 0.05 en el denominador en vez de (0.05-x), pero si tú no la haces ya me queda la duda! ¿Podría hacerlo en este problema entonces?
Muchísimas gracias por tus videos y esfuerzo, son de gran ayuda 🙂
Desirée
Desirée, 10 Años Antes
¡Hola! No te preocupes, puedes utilizarlo sin problemas, yo no suelo usar aproximaciones pero no por nada, sino por costumbre de resolver la ecuación y ya está. De hecho te animo a que lo calcules con aproximación y compares los resultados, verás que varían poco. Un saludo grande y muchas gracias por tu comentario.
QuimiTube, 10 Años Antes
Muchísimas gracias, ni os imagináis cuanto me ha ayudado ese video. Muchísimas gracias de nuevo.
David, 10 Años Antes
Hola David, me alegra mucho que te haya ayudado. Lamento que la imagen no sea muy buena pero está dentro de nuestras tareas pendientes volverlo a grabar con mejor calidad. Un saludo grande y gracias por tu comentario.
QuimiTube, 10 Años Antes
Hola. Muchas gracias por el video muy bueno en realidad. Solo una pequeña pregunta me podrías explicar lo de la ecuacion de segundo grado. Es que no entiendo de donde sale el 0,00189. Gracias 🙂
lily, 9 Años Antes
¡Hola! Es el resultado de la raíz cuadrada pero despreciando el primer término, (1,79·10-5)^2, ya que es un valor muy pequeñito (te quedaría del orden de 10^(-10) y lo ignoramos.
QuimiTube, 9 Años Antes
Hola! Primero que todo agradecerte por tus videos. Son de gran utilidad para mi estudio. Tengo una duda acerca de un ejercicio que me dejaron: hallar el pH de una solución de ácido perclórico 2,5 M, cuya constante de acidez tiende al infinito. Qué significa lo último??!! Muchas gracias.
Sandra, 9 Años Antes
¡Hola Sandra! Significa que es un ácido fuerte, que se disocia por completo cuando está en agua, como ocurre con el HCl y el HNO3. Eso significa que es mucho más fácil calcular el pH, ya que se hace así:
http://www.quimitube.com/videos/calculo-del-ph-de-un-acido-fuerte-2
QuimiTube, 9 Años Antes
Hola!, antes que nada darles las gracias por los vídeos y la enhorabuena.
Mi duda es la siguiente: mi profesor a veces desprecia algunos valores de x, es decir, cando va a hallar la x, si esta por ejemplo (0.1-x) , desprecia directamente la x, por lo que la ecuación resulta mucho mas fácil de resolver. Quiera saber cuando se puede hacer esoy cuando no, muchas gracias!
Nicole, 9 Años Antes
¡Hola! Normalmente podemos despreciar x cuando el valor de la constante es del orden de 10^(-5) o inferior, aunque no es una norma general. Yo habitualmente suelo hacer la ecuación completa, pero es cierto que despreciando se simplifica el ejercicio. Un saludo.
QuimiTube, 9 Años Antes
Gracias, pero eso por qudese puede hacer asi? Y con inferiores a que te refieres? Un saludo!
Nicole, 9 Años Antes
Se puede hacer así porque se ha comprobado con cálculos que el valor de pH obtenido despreciando y sin despreciar en estos casos varía muy poquito, a lo mejor con uno obtienes 4,783 y con otro 4,784, por ponerte un ejemplo numérico.
Con inferiores me refiero a con valores negativos mayores en el exponente, 10^(-5), 10^(-6), 10^(-7)… A medida que aumenta ese valor, al ser el exponente negativo, el resultado final es cada vez más pequeñito.
QuimiTube, 9 Años Antes
Buenas! Tengo una duda sobre un ejercicio, sé como se resuelve pero no sé llegar por mi misma a esa conclusión. ´´Determina la molaridad de una disolución de ácido cianhídrico ionizado al 2% sabiendo que ka = 4.9·10^(-10)´´
Por lo que para resolverlo hago lo siguiente: X=Ka/alfa que me da 2.4·1^(-8) y M=X/alfa —> M=2.4·10^(-8)/0.02 —> M=1.2·10^(-6)
El resultado esta bien porque tengo la solución, pero no sé como llegar a esa conclusión, muchas gracias!
Nicole, 9 Años Antes
¡Hola! Mira, en este otro ejercicio tenemos el valor de Ka y el grado de disociación:
http://www.quimitube.com/videos/ejercicio-8-calculo-del-ph-de-un-acido-debil-a-patir-de-ka-y-el-grado-de-disociacion
Y puedes ver cómo sacar a partir de ahí el pH planteando el equilibrio químico y no aplicando directamente la fórmula. Espero que te sirva para ver cómo se deduce. Un saludo grande.
QuimiTube, 9 Años Antes
Hola, si supiera que tengo 100mL de esa disuloción el pH variaría?
Muchas gracias!
jjmm, 9 Años Antes
¡Hola! Si la concentración es la misma el pH no variará, solo depende de la concentración no del volumen total.
QuimiTube, 9 Años Antes
Hola, tengo una duda.
Al escribir las reacciones, ¿cuando tengo que añadir agua en los reactivos?
Gracias por tus videos!!
xxx, 9 Años Antes
¡Hola! En el caso de los ácidos, ya que la molécula de agua actúa como base captando un H+ para dar H3O+. Así:
HA + H2O = A- + H3O+
Esto a veces se omite en los ácidos fuertes, pero si lo pones no estará mal.
Y también en algunas bases como el amoníaco:
NH3 + H2O = NH4+ + OH-
Pero en bases como los hidróxidos, las bases fuertes más habituales, no se pone:
NaOH –> Na+ + OH-
Ya que el agua no interviene de forma directa.
Un saludo
QuimiTube, 9 Años Antes
Hola!
Una duda; como saber por medio de una ecuación química, que estamos trabajando con un ácido fuerte o débil, o una base fuerte o débil?
Gracias!
Belen, 9 Años Antes
Hola Belén, cuando tienes un ácido fuerte no tendrás doble flecha, sino una sola flecha, lo que implica que el ácido se disocia totalmente (o la base). Si por el contrario es una base débil o un ácido débil tendrás un equilibrio químico que puede transcurrir en los dos sentidos, por lo que tendrás la doble flecha de equilibrio químico. Por otra parte, si es débil, te darán su valor de Ka o de Kb, mientras que en los fuertes no te dan este dato porque las constantes son prácticamente infinito. Además te conviene saber más o menos cuáles son los ácidos débiles y fuertes habituales:
http://www.quimitube.com/algunos-acidos-y-bases-fuertes-de-uso-comun
QuimiTube, 9 Años Antes
[…] (Puedes ver cómo se calcula esto en el ejercicio sobre el cálculo del pH de un ácido débil). […]
¿Cambia una constante de equilibrio con la dilución? | Quimitube, 8 Años Antes
Muchas gracias por hacer estos vídeos ayudan bastante estoy en 1 semestre de química y farmacia y la verdad estos temas hay que tenerlos claros saludos desde Barranquilla, Colombia
Manuel Jimenez, 8 Años Antes
Muchas gracias Manuel y bienvenido. Suerte con tus estudios.
QuimiTube, 8 Años Antes
Como calcular el pH de una solución si solo tengo como dato la constante Ka?
Fer, 5 Años Antes
Hola Fer, necesariamente debes tener también la concentración, sino solo podrías dejar el pH indicado en función de ella.
QuimiTube, 4 Años Antes
. Calcular el pH de una disolución 0,02 M de ácido débil HA (constante de acidez Ka= 3,0·10-6) *
a) 3
b) 3,5
c) 3,6
d) 3,4
michael, 4 Años Antes
Hola Michael, ¿has probado a hacer el ejercicio tal y como explicamos en el vídeo? No tiene sentido que yo te diga la respuesta. Un saludo.
QuimiTube, 4 Años Antes