Contenido del Vídeo
La hipótesis de Planck de 1900 sobre la naturaleza corpuscular de la luz fue muy mal acogida por la comunidad científica por romper todos los preceptos de la física clásica. No fue aceptada hasta que, en 1905, Einstein la usara para poder explicar un fenómeno inexplicable hasta entonces, el efecto fotoeléctrico, descrito por Hertz en 1887.
Dicho efecto fotoeléctrico consiste en la emisión de electrones por parte de un metal al ser irradiado con radiación electromagnética. Sin embargo, no sirve cualquier radiación electromagnética: tiene que tener una determinada frecuencia, denominada frecuencia umbral. Por debajo de dicha frecuencia umbral no se produce efecto fotoeléctrico, aunque aumentemos muchísimos la intensidad de la radiación. Por encima de la frecuencia umbral sí que se produce el efecto fotoeléctrico y la emisión de electrones es mayor a medida que aumentamos la intensidad de la radiación.
Cabe destacar que cada metal presenta una frecuencia umbral característica.
La ecuación de Einstein para el efecto fotoeléctrico es:
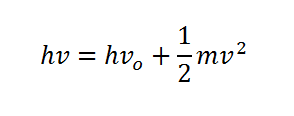
También te puede interesar el siguiente ejercicio:
Category: Estructura atómica y Estructura de la materia.
Etiquetas: Bases de la mecánica cuántica.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
felicidades, proyectos y personas como uds hacen que este mundo sea mucho mejor. excelente docente.
hugo jimenez, 12 Años Antes
Muchas gracias Hugo y bienvenido, me alegro de que pienses así 🙂 Un saludo grande
QuimiTube, 12 Años Antes
Hola:
A mí me gustaría preguntarte al respecto de la intensidad de la luz. Hasta donde entiendo, la intensidad es una medida del número de fotones que «transporta» la luz (por así decirlo).
Así que supongamos dos radiaciones electromagnéticas de igual frecuencia (y por tanto energía), y supongamos que las dos superan la frecuencia umbral. Supongamos también que la única cosa en la que se diferencian estas dos radiaciones, es en la intensidad.
Entiendo que una intensidad mayor son más fotones incidiendo sobre el metal, y arrancarán los electrones con una velocidad X (que calcularíamos con la ecuación de Einstein del efecto fotoeléctrico). Los electrones arrancados por la radiación de menor intensidad pero de misma energía, tendrán la misma velocidad, ya que ésta depende únicamente de la frecuencia de la radiación incidente. Sin embargo, se arrancarán menos electrones.
Mi pregunta es, ¿cómo afecta esto al amperaje de la ilustración que muestras en el video? Yo diría que mayor número de electrones, significa una mayor corriente.
De ser así, imaginemos entonces dos radiaciones con frecuencias distintas (las dos superan la frecuencia umbral), pero con la misma intensidad. Los electrones emitidos por efecto de la luz de mayor frecuencia tendrán más velocidad que los electrones emitidos por la radiación de menor frecuencia. ¿cómo afectaría esto a la corriente eléctrica?
Muchísimas gracias por el video y por leerme. Un saludo 🙂
Yonathan, 11 Años Antes
Hola Yonathan, me ha encantado tu comentario, un razonamiento muy bueno y muy agradable de seguir. En efecto, en el primer caso que planteas, de dos radiaciones de la misma frecuencia pero distinta intensidad, parece lógico pensar, como tú comentas, que aumentará la intensidad de corriente porque el número de electrones es mayor. En cambio, en el segundo caso, de dos radiaciones de la misma intensidad (mismo número de fotones) pero distinta frecuencia (distintas velocidades) yo diría que no afectará a la corriente eléctrica, aunque se trata de un tema en el que resultaría muy interesante profundizar, si averiguo más cosas lo comentamos 🙂 Un saludo.
QuimiTube, 11 Años Antes
¡Qué divertido!
Yo también miraré a ver qué encuentro. Si encuentro algo y no me has comentado aún, eso haré yo. Aunque ando tan liado que a ver…
yonathan, 11 Años Antes
disculpa, trato de superar mis falencias quimicas y quisiera saber como hallar la frecuencia humbral alguien me podria ayudar porfavor
Luis alberto zabala, 11 Años Antes
¡Hola! Imagino que te refieres a la frecuencia mínima necesaria para ionizar un metal. Puedes verlo con este ejemplo para el sodio:
http://www.quimitube.com/videos/calculo-de-la-frecuencia-necesaria-para-ionizar-el-sodio/
QuimiTube, 11 Años Antes
Ante todo, Gracias por los videos.
Tengo una duda en lo que respecta la polaridad de los electrodos, ya que los electrones se mueven hacia el ánodo y yo lo que tenía entendido es que los electrones van hacia el cátodo, por eso de que ganar electrones es reducirse y que en una pila el cátodo tiene polaridad positiva.
Muchas gracias
Gonzalo, 11 Años Antes
Hola Gonzalo, bienvenido:
Decimos que en el cátodo se produce la reducción, pero no es la reducción del cátodo, sino de las especies que están en la disolución donde el mismo está sumergido. Como se dará la reducción sobre la superficie del cátodo, necesitas electrones adicionales para poder llevar a cabo dicha semirreacción. Por ejemplo, en la pila Daniell, en el compartimento del cátodo tendrás que el Cu(II) pasa a Cu metálico, por lo que habrá que captar dichos electrones:
Cu(II) + 2e = Cu(0)
¿Y de dónde procederán estos electrones? De la oxidación del ánodo de zinc (esta vez sí que se oxida el propio ánodo), que pasa de Zn metálico a Zn(II). Cada vez que un átomo de Zn del ánodo se oxida se desprenden 2 electrones en dicho ánodo, que deberán circular desde el ánodo al cátodo para que se pueda dar la reducción del cobre. Así, el flujo de electrones es del ánodo (donde los electrones se «generan») al cátodo (donde los electrones se «consumen»).
No sé si te lo habré aclarado.
Un saludo,
Carmen
QuimiTube, 11 Años Antes
Hola, yo quiero saber que tipo de lámparas necesito para liberar electrones de una placa de zinc. Es para comprobar el efecto fotoelectrico. Gracias
José Luis Bautista, 11 Años Antes
Hola José Luis, no te sé decir exactamente cuál, debes fijarte en la frecuencia umbral de los electrones del zinc (tal vez lo puedas hallar tabulado, si no lo puedes calcular con la energía de ionización del mismo) y una vez que sabes esto, cualquier frecuencia superior a la umbral te servirá para ionizarlo.
QuimiTube, 11 Años Antes
Es acojonante. creo que es la mejor web que he visto hasta ahora para aprender. Me encanta la camisa del gato, una mujer guapa, lista y sin complejos, la mujer ideal. Animo y no abandones nunca, sigue transmitiendo tus conocimientos por siempre jamás
Jorge Carreño, 11 Años Antes
Jajaja, muchas gracias por tu comentario Jorge, me has hecho sonreír. Me alegra que te gusten los contenidos, están elaborados con mucho cariño y aún seguiremos añadiendo cosas nuevas. Un saludo grande.
QuimiTube, 11 Años Antes
Muy bien el video! si puedes anadirle un comenrario al video para que quedo perfecto seria: que signica frecuencia umbral.
Como yo no lo sabia, al principio no entendi pero ya que se el significado todo va bien! 🙂
Gracias
Sachet, 11 Años Antes
a mi tambien me encanta la blusa esta! que chulaaa!
Sachet, 11 Años Antes
Hola, tengo una duda; por lo que entiendo sobre efecto fotoelectrico basta con un solo foton(con la frecuencia y energia suficiente) para arrancar un electron del atomo. Pero tambien he leido acerca de ENERGIA DE IONIZACION, y la energia que se necesita para ionizar un atomo (osea arrancar un electron) es grandisima comparada con la energia de un solo foton. Bueno quisiera porfavor que me explicar un poco de eso que estoy muy confundido
Juan Nano, 11 Años Antes
Hola Juan, lo que ocurre es que la energía de ionización generalmente viene dada en eV/mol o kJ/mol, y por tanto es la energía necesaria para ionizar un mol de átomos, 6,023·10^23 átomos. Si tú multiplicas la energía necesaria de un solo fotón por el número de Avogadro, obtendrás la energía de ionización.
QuimiTube, 11 Años Antes
Quiero decirte que gracias a esta página pude prepararme la PAU y, aunque mi nota en química fue un 6,5 (hice visitas expres a esta pàgina una semana antes de tenerla y si aprobé fue gracias a eso) entré en medicina, que era lo que quería. No tenía buena base pero aun así lo que conseguí hacer bien fue gracias a ti. Estoy segura de que mucha gente consiguió su objetivo de la misma manera que yo.
Ojalá hubiera descubierto esto cuando empecé 2º de bachillerato en lugar de días antes de la selectividad. Muchas gracias! 😀
Nora, 11 Años Antes
¡Hola Nora! Muchas gracias, me hace mucha ilusión que ahora que ya ha pasado tiempo desde la selectividad vuelvas por aquí para dejar este comentario 🙂 Enhorabuena por tu entrada en medicina, muchos alumnos que entran en esta página tienen ese objetivo y cuando sé de alguno de vosotros que lo ha conseguido le veo un sentido. Gracias de nuevo y muchísima suerte en tu nueva etapa. Un abrazo.
QuimiTube, 11 Años Antes
Hola me alegro demasiado ver los contenidos y sobre todo la fácil comprensión de ellos… Muy buena explicación precisa sobre todo de una mujer tan guapa… Exitos!!! Saludos
Sam, 10 Años Antes
¡Muchas gracias y bienvenido!
QuimiTube, 10 Años Antes
hola me gustaria saber como quedaria despejada la formula para sacar la V y la V. y la V^2..!! espero y me puedan ayudar.. saludoos..!
flavio, 10 Años Antes
Hola Flavio, para despejar, por ejemplo, v^2, pasarás restando al otro lado h·vo, después pasarás el 2 multiplicando y la m dividiendo, es decir, 2(hv – hvo)/m = v2
Luego, para despejar v harás raíz cuadrada de esto.
Son cálculos matemáticos sencillos como si fuese una ecuación normal con x o con y.
Un saludo.
QuimiTube, 10 Años Antes
hola, muchísimas gracias por la explicación..!! 😀 otra pregunta, un libro que me puedan recomendar para estos temas estoy en 1er semestre de la universidad. saludos.
flavio, 10 Años Antes
Cualquier libro de química general te podrá servir, por ejemplos el Chang o el Brown.
QuimiTube, 10 Años Antes