Contenido del Vídeo
Cuando se forma un enlace químico estable se desprende una cierta cantidad de energía, que será la misma cantidad de energía que se debe aportar posteriormente para romper el enlace formado. A esta energía se la denomina entalpía de enlace (si tiene lugar a presión constante) o, más coloquialmente, energía de enlace. Así, podemos definir la entalpía de enlace normal o estándar como la variación de entalpía o calor liberado, en condiciones estándar de 1 atmósfera y 25ºC, que acompaña a la reacción de formación de un mol de enlaces a partir de los átomos aislados en estado gaseoso. Como cuando se forma un mol de enlaces se desprende energía, la entalpía de enlace de este proceso será negativa:
Si en lugar de considerar la reacción de formación de un mol de enlaces consideramos la reacción inversa, es decir, la disociación de un mol de Cl2, la entalpía de dicha reacción tendrá la misma magnitud pero signo contrario:
Cuanto mayor es el valor absoluto de energía de enlace, mayor es la fortaleza de dicho enlace. Por ejemplo, para la reacción de formación de un mol de H2 a partir de los átomos de H en estado gaseoso:
Como la entalpía o energía de enlace es mayor para la molécula de H2 que para la molécula de Cl2, significa que el enlace H-H es más fuerte que el enlace Cl-Cl.
El valor de la energía de enlace puede determinarse de forma precisa para moléculas diatómicas, como las del ejemplo, y también O2, N2, F2… y para moléculas poliatómicas que tengan todos los enlaces iguales, como H2O, NH3 o CH4. Pero cuando tenemos moléculas poliatómicas con enlaces de distinto tipo, determinar la energía de enlace precisa no es posible. Por ello, en verdad se toma una entalpía de enlace media y los valores que aparecen en tablas se han calculado a partir de distintas moléculas que presentan dicho enlace. Por este motivo, las entalpías de enlace tabuladas presentan un margen de error; no son precisas, y sólo se usan para realizar cálculos aproximados cuando no se dispone de otros valores experimentales precisos, como las entalpías de formación de los compuestos que intervienen en la reacción.
Además, sólo son aplicables para moléculas covalentes sencillas, no siendo aplicables para compuestos muy polares o iónicos, ya que éstas presentan fuerzas electrostáticas que afectan a las entalpías de enlace.
Vemos a continuación una tabla con los valores de entalpía de diversos enlaces. Clicando sobre ella se puede descargar en modo imagen, y también en PDF en el enlace inferior.
Tabla de entalpías o energías de enlace en PDF
Category: Teoría de Termoquímica y Termodinámica Química.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad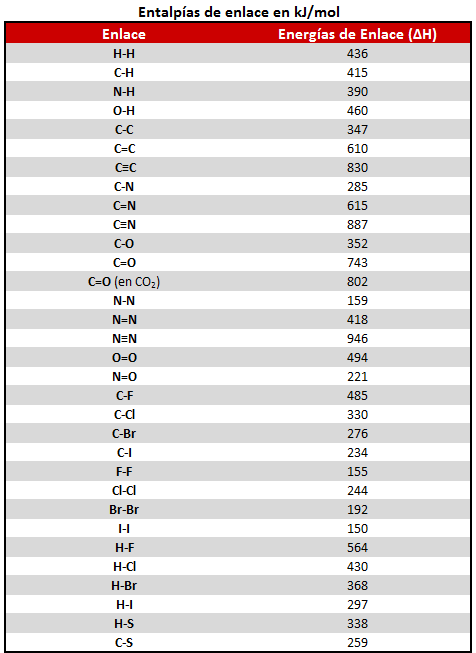
Hola quería saber si podes determinar en forma aproximada el calor de reacción utilizando el concepto de energía de enlace de las siguientes reacciones:
a)síntesis del amoniaco
b)combustión del metano
c)síntesis de la glucosa.
Yo vi un video sobre HCl pero no me quedo claro como utilizar la fórmula yo hice en el caso de la síntesis de amoníaco:
N2 (g) + 3H2(g) ————— 2 NH3 (g)
deltaH°r = (1*E N-N + 3* E H-H) – (2* 3* E N-H)
= (1* 159 kj/mol + 3 * 436 kj/mol) – (2 * 3 * 390 kj/mol)
= 1467 kj/mol – 2340 kj/mol
= -873 kj/mol
PD: Mi duda es si en el caso del enlace N-H hay que multiplicar por 3 porque es NH3 o multilicar por 1/3, el 2 que aparece multiplicando en la formula es por estequiometria del enlace N-H, como el 1 del enlace N-N y el 3 del enlace H-H. Espero me puedas ayudar. Gracias.
Agustina, 11 Años Antes
Hola Agustina, lo has resuelto muy bien, así como has escrito 2*3*E N-H, ya que en una molécula de amoníaco tienes tres enlaces N-H, y debes tener en cuenta la formación de estos tres enlaces. Además, como en la estequiometría de la reacción tienes 2 moléculas de amoníaco y por cada una de ellas hay 3 enlaces, en total se formarán 6 enlaces N-H, de ahí que escribas 2*3*E N-H.
QuimiTube, 11 Años Antes
N2 tiene un enlace triple, no sencillo
Jose, 11 Años Antes
¡Hola Jose! Sí, el N2 tiene enlace triple, pero en este vídeo no aparece, tal vez lo hayas confundido con el H2, que sí sale, aunque la definición del vídeo es buena. Un saludo.
QuimiTube, 11 Años Antes
me gustaria saber si ¿existe diferencia en los valores de etalpia en los enlaces covalente polar, covalente no polar y en lace ionico?
guadalupe, 11 Años Antes
Cual de los siguientes elementos tiene la entalpia de enlace electronica mas negativa?
Na, Mg, O y P
Como obtengo dicho entalpia por elemento?
Carlos Alcala, 10 Años Antes
Hola Carlos, no entiendo a qué te refieres «con entalpía de enlace electrónica», ¿tal vez te refieras a la energía de la red metálica formada? Un saludo.
QuimiTube, 10 Años Antes
Hola Carmen, tengo una duda. En el video anterior decias que considerasemos como 0 la entalpia de formacion de los elementos puros, pero aqui la entalpia de formacion del cl2 y h2 no es 0. ¿No es lo mismo la entalpia de formacion y la entalpia de enlace? ¿O acaso es porque los elementos los encontramos siempre en la naturaleza en forma diatomica y no aislados y por eso es 0?
Muchas gracias por todos tus videos y las explicaciones de una mujer tan lista y guapa!! Me estan ayudando un montón en 2º de bachillerato
Fernando, 9 Años Antes
Hola de nuevo, acabo de ver que en el siguiente video de teoria ya han hecho la misma pregunta y me ha quedado claro. Gracias
Fernando, 9 Años Antes
Perfecto, me alegro que te haya servido. Si aún te quedan dudas aquí estamos. Gracias por comentar, un saludo grande.
QuimiTube, 9 Años Antes
Hola, tengo una duda, me han asignado un taller en el que la entalpía es igual a cero, y me piden explicar que significa esto, podéis ayudarme?
Paula, 9 Años Antes
¡Hola! Significa que la entalpía de los productos y de los reactivos son iguales, ya que tienes que:
DH = Hproductos – H reactivos.
En un gráfico en el que se represente la entalpía tendrías productos y reactivos a la misma altura.
QuimiTube, 9 Años Antes
Hola, muy buena profesora definitivamente se nota la vocación de docente 🙂 . Me ha surgido una consulta, si un mol de enlace C-C posee una entalpía de 347 kj/mol y un mol de C(doble enlace)C de 610 kj/mol, ¿se puede decir entonces que un mol de enlace Pi entre los carbonos es de (610 kj/mol – 357 kj/mol)? perdón me dio pereza sacar la diferencia jaja
Pedro Espinoza, 9 Años Antes
¡Hola Pedro! En efecto podrías verlo de este modo, me parece correcto. Seguramente habrá una cierta diferencia (el hecho de que el enlace sea doble afectará a la energía del enlace sigma, pero no creo que sea muy determinante). Un saludo grande.
QuimiTube, 8 Años Antes
Buenos días
Que tan recomendable es usar la expresión de la suma de las energías de enlaces rotos menos la suma de las energías de los enlaces formados multiplicados por sus respectivos coeficientes estequiometricos para calcular la entalpia de reacción cuando aparecen moleculas diatomicas como Al2, Mg.
De antemano gracias
eduardo, 8 Años Antes
Hola Eduardo, también se puede usar cuando hay moléculas diatómicas como H2, O2… Aunque los ejemplos que pones, aluminio y magnesio, no forman moléculas diatómicas. Un saludo.
QuimiTube, 8 Años Antes
Hola! Una duda sobre este tema: en la reaccion
CH4+H2O(g)–>CO+3H2(g), al calcular la entalpia de reaccion apartir de las energias de enlace, el CH4 cuenta como 4x(C-H) y el H2O como 2x(H-O)???
Muchas gracias, sois geniales
Un saludo!!
Alejandro, 8 Años Antes
¡Hola Alejandro! En efecto, tienes que contar 4 enlaces C-H para el metano y 2 enlaces H-O para el agua, tantos enlaces como tengas en la molécula completa. Gracias por tu comentario, un saludo.
QuimiTube, 8 Años Antes
La profesora que sale en el video ¿Es casada?, me gustaría una esposa asi.
Eduardo, 7 Años Antes