Contenido del Vídeo
En 1935, Henry Eyring y sus colaboradores elaboraron la Teoría del Complejo Activado o Teoría del Estado de transición para explicar a nivel molecular cómo transcurren las reacciones químicas. En dicha teoría se postula que cuando las moléculas de los reactivos se aproximan, experimentan una deformación y dan lugar a un estado intermedio transitorio, denominado Estado de Transición. Dicho Estado de Transición es de muy alta energía y muy corta duración, y en el mismo se forma una estructura transitoria de máxima energía que se denomina Complejo Activado (formado por todos los átomos implicados en la reacción).
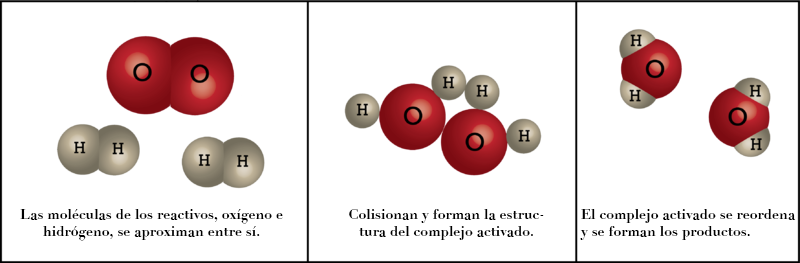
Para que se forme el Complejo Activado, es necesaria una cierta cantidad de energía, denominada Energía de Activación. Es decir, se puede decir que:
La Energía de Activación es la energía necesaria para que se forme el complejo activado.
Para el estudio energético del Estado de Transición y de la Energía de Activación es muy útil el uso de diagramas energéticos o diagramas entálpicos vistos en el tema de termoquímica.

Si los recordamos, en dichos diagramas dibujamos una montaña en el transcurso de la reacción correspondiente a un máximo de energía. Este máximo de energía es el Estado de Transición. La Energía de Activación es la diferencia entre la energía de los reactivos y la energía del Complejo Activado, es decir, la subida de la montaña.
Esta Energía de Activación se relaciona directamente con la velocidad de una reacción química. Cuanto más pequeña sea le energía de activación, más rápida será la reacción química (mayor velocidad de reacción) porque más fácilmente alcanzarán los reactivos al chocar la energía del Estado de Transición y formarán el Complejo Activado. Es decir, el Estado de Transición será más asequible o fácil de alcanzar.
También te puede interesar:
Cinética Química Teoría 2: Velocidad de reacción
Cinética Química Teoría 3: Teoría de colisiones
Category: Cinética Química y Teoría de Cinética Química.
Etiquetas: Energía de activación.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Enhorabuena por vuestros vídeos!. El contenido que subís es maravilloso y me esta ayudando con la asignatura así que muchísimas gracias 🙂
Alberto Sánchez, 10 Años Antes
Hola Alberto, muchas gracias a ti por dedicar un ratito para dejar este comentario que nos anima a continuar con los vídeos de hoy. Un saludo grande.
QuimiTube, 10 Años Antes
¿Tenéis solubilidad explicada?
Cristina Gómez, 10 Años Antes
¡Hola Cristina! No, lo lamento, todavía no, aunque la vamos a grabar con la teoría de equilibrio químico (que ya estoy preparando) dentro de los equilibrios heterogéneos. Espero que en un par de semanas esté lista, pero no podrá ser antes. Un saludo grande.
QuimiTube, 10 Años Antes
Gracias por tus videos, me estan salvando de no ir a septiembre=))) sique asi
Mihaela, 10 Años Antes
Me alegra que te sirvan 🙂 ¡Mucha suerte!
QuimiTube, 10 Años Antes
Genial tus videos, más claro que el agua! 🙂
Beatriz, 9 Años Antes
Muchas gracias por los vídeos, una vez vistos ya no tienes mas dudas. Creo que mis notas se vasan en vuestros vídeos. I no me va nada mal 🙂
Noelia, 9 Años Antes
hola! la energía de activación de la reacción endotermica esta bien marcada en el gráfico? gracias
leonardo, 9 Años Antes
¡Hola! Sí, la energía de activación de la reacción directa siempre es la diferencia entre la energía de los reactivos y del estado de transición. Un saludo.
QuimiTube, 9 Años Antes
Muchas gracias por la información!
Me podrias proporcionar los datos bibliograficos, por favor?
karina vega, 8 Años Antes
Hola Karina, todos los temas los elaboro yo pesonalmente, no podría darte datos bibliográficos, si necesitas citarlo puedes citar la página web. Un saludo.
QuimiTube, 8 Años Antes