Contenido del Vídeo
¿Cómo ocurren las reacciones químicas? La Teoría de colisiones
En 1920, Gilbert N. Lewis y otros, estudiando los factores que afectaban a la cinética química, propuso la llamada Teoría de Colisiones, cuya finalidad es explicar cómo transcurren las reacciones a nivel molecular. Según esta teoría, para que una reacción química tenga lugar, las moléculas de los reactivos deben chocar, y además deben chocar de forma eficaz, es decir, no todas las colisiones de reactivos llevan a la formación de productos, solo algunas de ellas.
Si consideramos un recipiente que contiene dos gases que reaccionan entre sí, por ejemplo Cl2 y H2, para dar cloruro de hidrógeno, en un segundo se pueden producir del orden de 1030 colisiones. Las moléculas de Cl2 y H2 son gases, se están moviendo constantemente de forma caótica por el recipiente y es normal que se crucen sus trayectorias aleatorias y choquen. Pero si los 1030 colisiones en un segundo diesen lugar a HCl, la reacción se completaría en tan solo una fracción de segundo inapreciable, algo que no sucede en la realidad. Y no sucede porque, como decimos, muchos choques no son eficaces, no conducen a la formación de productos. Para que los choques sean eficaces y los reactivos que chocan se conviertan en productos, se deben dar dos condiciones:
1. Que las moléculas de los reactivos tengan una orientación adecuada para que la reacción se lleve a cabo. Por ejemplo, consideremos la reacción entre H2 y Cl2 para dar HCl con un modelo molecular:
Orientación adecuada
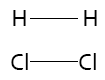
Orientación inadecuada
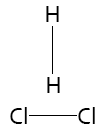
2. Que las moléculas de reactivos tengan suficiente energía cinética en el momento del choque para que se produzca la ruptura de sus enlaces y se formen los enlaces de los productos.
A esta energía, la energía cinética necesaria para que un choque sea efectivo y se rompan los enlaces de los reactivos, se la denomina Energía de Activación.
El concepto de Energía de Activación es muy importante en el estudio de una reacción. Esta definición que acabamos de indicar es la basada en la teoría de colisiones. En el próximo apartado de teoría, relativo a la teoría del complejo activado , definiremos nuevamente el término de energía de activación, aunque de un modo un tanto distinto.
También te puede interesar:
Cinética Química Teoría 2: Velocidad de reacción
Cinética Química Teoría 4: Teoría del estado de transición o teoría del complejo activado
Category: Cinética Química y Teoría de Cinética Química.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Cual es el orden en esta sección? Estoy un poco perdido
Javier, 9 Años Antes
¡Hola! Perdona es que tenemos que hacer cambios para ordenarlo bien pero no hemos tenido tiempo. Aquí tienes el orden de la teoría:
http://www.quimitube.com/teoria-cinetica-quimica
Y aquí los ejercicios:
http://www.quimitube.com/ejercicios-cinetica-quimica
QuimiTube, 9 Años Antes