Contenido del Vídeo
Como hemos indicado en el apartado previo, cuando se comparan los órdenes de reacción de la ecuación de velocidad de cada uno de los reactivos y sus coeficientes estequiométricos en la reacción, no tienen porqué coincidir, por lo que para determinar la ecuación de velocidad de la reacción se debe determinar experimentalmente. El motivo de que ambos valores no coincidan es que muchas reacciones químicas transcurren en dos o más etapas. Para cada una de las etapas sí que coincidirá el coeficiente estequiométrico del reactivo o producto con el orden de reacción de la ecuación de velocidad, pero en la reacción global, sumadas todas las etapas, no será así.
Cada una de las etapas por las cuales transcurre la reacción se denomina «Etapa elemental o proceso elemental» y a la secuencia de estas reacciones sencillas, la suma de las cuales nos da la reacción global, se la denomina mecanismo de reacción.
Reacción química elemental o en una sola etapa
Cuando tenemos una reacción elemental, que transcurre en una sola etapa, sí que coinciden los coeficientes estequiométricos con el orden de reacción. Por ejemplo:
A + B → C
Reacción elemental (1 etapa)
v = k·[A]·[B]
n = 1; m = 1
a = 1; b = 1
Estas reacciones se producen en una sola colisión, y considerándolas podemos introducir otro concepto de importancia, la molecularidad.
Se denomina molecularidad al número de moléculas que chocan en la etapa elemental de una reacción química para dar lugar a productos. En la reacción del ejemplo, la molecularidad es 2 porque deben chocar una molécula de A y una molécula de B para dar lugar a la reacción. Se dice, entonces, que es un proceso bimolecular.
1 molécula (disociación) – Unimolecular
2 moléculas – Bimolecular
3 moléculas – Trimolecular
La mayoría de procesos elementales son unimoleculares (una sola molécula que se escinde o se disocia) o bimoleculares (dos moléculas que colisionan). Se conocen muy pocos casos de procesos trimoleculares, ya que enestos el producto debe formarse como resultado de un choque simultáneo y eficaz de 3 moléculas, lo cual es muy poco probable.
Reacción química por etapas
En una reacción por etapas, el orden de reacción no coincidirá con los coeficientes estequiométricos. Por ejemplo, en la reacción:
2A + 2B → C + D
Si fuese en una sola etapa, su ecuación de velocidad sería:
v = k·[A]2·[B]2
Sin embargo, supongamos que su verdadera ecuación de velocidad es:
v = k·[A]·[B]
De primer orden respecto de A y de primer orden respecto de B.
Esto ocurre porque no ese un proceso elemental, sino que se da en una serie de etapas, que podrían ser:
Etapa 1: A + B → D + E
Etapa 2: A + E → F
Etapa 3: F + B → C
2A + 2B + E + F → D + C + E + F
2A + 2B → D + C
Como vemos, la suma de todas las etapas da lugar a la ecuación global. A la secuencia de las tres etapas desglosadas se la denomina mecanismo de reacción.
Las especies que se producen en un proceso elemental y se consumen en otro, como en el ejemplo las especies E y F, se denominan Intermedios de reacción, y no aparecen en la reacción global ni en la ecuación de velocidad global. Estos intermedios de reacción son especies fugaces y normalmente no se pueden medir ni determinar, por lo que a menudo no se sabe con certeza el mecanismo de una reacción, sino que se debe proponer un mecanismo que sea consecuente con las observaciones experimentales realizadas.
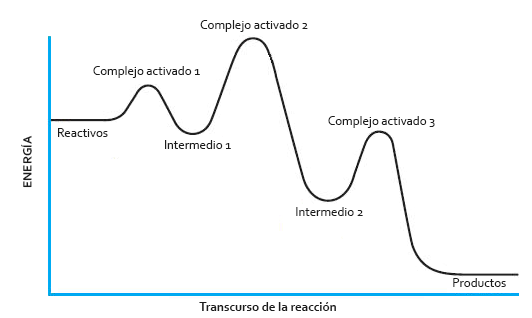
Diagrama energético de una reacción por etapas. Cada una de las etapas tiene su propia energía de activación, su propio complejo activado y su propia velocidad.
Como decimos, cada una de las etapas del mecanismo de reacción tiene su propia velocidad. A la más lenta de ellas se la denomina «etapa limitante de la velocidad» y su ecuación de velocidad coincide con la ecuación de velocidad de la ecuación global. Por este motivo, en nuestro ejemplo, la ecuación global de velocidad es v = k·[A]·[B], que coincide con la ecuación de velocidad del proceso elemental más lento. En este caso, tomando la etapa 1, el orden de reacción y el coeficiente estequiométrico sí que coinciden, porque se trata de un proceso elemental.
También te puede interesar:
Ejercicio 14 Cinética Química: mecanismo de la reacción entre el HBr y el O2
Ejercicio 15 Cinética Química: mecanismo de la reacción de descomposición del N2O
Category: Cinética Química y Teoría de Cinética Química.
Etiquetas: Mecanismo de reacción y Velocidad de reacción.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Muchisimas gracias por subir estos videos! son de gran utilidad! Explicas genial! ..un abrazo desde Argentina!
Alejandro, 10 Años Antes
Muchas gracias Alejandro, un saludo hasta Argentina.
QuimiTube, 10 Años Antes
Hola, tengo una consulta, lei en libros que si tenes por ej la reaccion
2A + 2B → C + D
la ecuacion de velocidad seria
v = k·[A]2·[B]2[C]·[D] (incluyendo en la ecuacion también los producto), esto es correcto? no entiendo porqué la escribiste sin los productos, gracias!! excelentes clases
Lucia, 10 Años Antes
¡Hola! No, no es correcto, se indican solo los reactivos. Es posible que en casos concretos no sea así porque no se trate de un proceso elemental sino por etapas. Pero si es elemental, la ecuación de velocidad será v=k·[A]2·[B]2, sin añadir los productos en ningún caso. Un saludo y gracias por tu comentario.
QuimiTube, 9 Años Antes