Contenido del Vídeo
En este segundo vídeo de teoría de cinética química (Teoría cinética química 1: Introducción a la cinética química) profundizaremos en los conceptos de velocidad media, velocidad media general y velocidad instantánea para una reacción química.
Velocidad de reacción media, vm
Consideremos la reacción química:
A+B → C
A medida que esta transcurre, van desapareciendo reactivos, A y B, y va apareciendo el producto C. Es decir, la concentración de A, B y C varía a lo largo del tiempo. Determinar la velocidad de dicha reacción implica calcular la variación de esta concentración en la unidad de tiempo. No será lo mismo que la concentración de A pase de 2M a 1M en un segundo, en un minuto o en una hora. En el primer caso, la velocidad de reacción será mayor. Así, en primer lugar vamos a definir el concepto de velocidad media de reacción, que representaremos como vm.
Cuando tenemos una reacción homogénea, entre reactivos en disolución o entre gases, la velocidad media, vm, se calcula como el cociente entre la variación de la concentración molar (mol/L) de reactivos o productos y el intervalo de tiempo en el cual se produce esta variación. Matemáticamente, se expresa como:
![]()
Esta fórmula se puede leer como: «Variación de la concentración de R o P entre la variación de tiempo, incremento de tiempo o intervalo considerado en el que se ha producido dicha variación».
Puesto que la concentración en esta fórmula debe expresarse en molaridad, mol/L, y dividimos por el tiempo, las unidades de la velocidad de reacción en el SI son mol/L·s o mol·L-1·s-1.
¿Cómo se puede calcular esta velocidad media de reacción, vm? Debemos disponer de al menos dos valores de la concentración de alguna especie que intervenga en la reacción y de dos valores de tiempo. Supongamos que para la reacción antes indicada, A+B → C, se dispone de la siguiente tabla de concentraciones que se ha obtenido experimentalmente en el laboratorio:
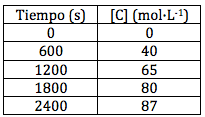
Vemos que la concentración de la especie C, en este caso el producto, se ha representado para distintos intervalos de tiempo. Al tratarse de un producto, su concentración va aumentando con el tiempo. Podemos aplicar la fórmula de la velocidad media utilizando ya el símbolo C, es decir:
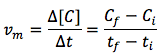
Como vemos, dicha fórmula se puede expresar también del segundo modo que aparece, con las concentraciones final e inicial de C (Cf y Ci) y el tiempo final e inicial (tf y ti).
Podemos aplicar la fórmula para calcular la velocidad media de reacción en cada uno de los 4 posibles intervalos:
Velocidad de reacción en el intervalo 1, de 0 a 600 segundos:
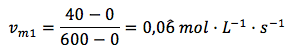
Velocidad de reacción en el intervalo 2, de 600 a 1200 segundos:
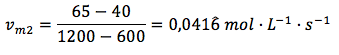
Velocidad de reacción en el intervalo 3, de 1200 a 1800 segundos:
![]()
Velocidad de reacción en el intervalo 4, de 1800 a 2400 segundos:
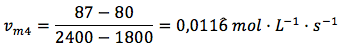
Como vemos, hemos obtenido un valor de velocidad media de reacción distinto para cada uno de los intervalos considerados. ¿Es esto correcto? Sí, de hecho siempre es así. La velocidad de una reacción química no es constante a medida que va transcurriendo, ya que la concentración de reactivos es cada vez menor. Por tanto, para el mismo intervalo de tiempo, en el ejemplo de 600 en 600 segundos, la velocidad media de la reacción va disminuyendo, aproximándose a 0, que es el valor que tendrá la velocidad cuando la reacción se haya completado. Es decir, todos los reactivos se hayan consumido por completo para transformarse en productos.
Velocidad media general, vmg
Hemos visto en el ejemplo anterior cómo calcular la velocidad media en función de las concentraciones de la tabla, que en este caso eran concentraciones del producto C. Sin embargo, en la fórmula de la velocidad media de reacción hemos indicado expresamente que se puede utilizar para su cálculo cualquier reactivo o producto que intervenga en la reacción. Así, vamos a ver qué ocurre si para una misma reacción química calculamos la velocidad de reacción utilizando cada uno de los productos y reactivos.
Considerando la reacción entre el hidrógeno gaseoso y el nitrógeno gaseoso para producir amoniaco:
N2 + 3H2 → 2NH3
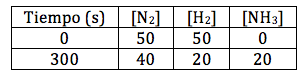
Si calculamos la velocidad media de la reacción en este intervalo de tiempo a partir de cada uno de los compuestos que interviene en la reacción, obtenemos:
En función del N2:
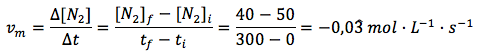
En función del H2:
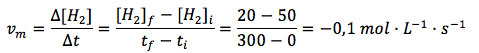
En función del NH3:
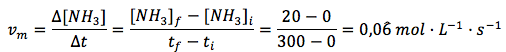
Se puede observar que se ha obtenido una velocidad positiva, partiendo del amoniaco, y dos negativas, partiendo de hidrógeno o nitrógeno. ¿Por qué son negativas las velocidades medias calculadas en función de los reactivos? Porque se trata de sustancias que desaparecen y, por tanto, sus concentraciones van disminuyendo, lo que hace que la variación de concentración sea negativa. Además, como vemos, las velocidades medias para un mismo intervalo, calculadas en función de los reactivos y productos, da valores distintos. Esto se debe a que también son distintos sus coeficientes estequiométricos al ajustar la reacción. La reacción y los coeficientes nos indican que por cada mol de nitrógeno que desaparece, desaparecen 3 moles de hidrógeno y se forman 2 moles de amoníaco. Las proporciones no son equivalentes.
Para evitar esto, es decir, el obtener un resultado distinto según usemos uno u otro compuesto como referencia, la IUPAC recomienda utilizar la llamada velocidad media general, vmg, la cual incluye en la fórmula la relación estequiométrica entre las distintas sustancias que intervienen en la reacción. Si consideramos la reacción química general:
aA + bB → cC + dD Donde: a, b, c y d son los correspondientes coeficientes estequiométricos de cada especie.
Entonces, la velocidad media general (también indicada en muchas ocasiones simplemente como velocidad media, prescindiendo de la g, ya que es la velocidad más usada, vm) es:
![]()
Se multiplican por el valor inverso del coeficiente estequiométrico. Se incluye, asimismo, un signo negativo en los reactivos, A y B, porque como la concentración de A y B va disminuyendo (se pierden al reaccionar) será negativa su variación, y con el signo negativo impuesto ambos signos se compensan, que dando una velocidad media positiva en todo caso.
Si utilizamos la expresión indicada para la reacción de formación del amoníaco, entonces:
Velocidad media general en función del nitrógeno:
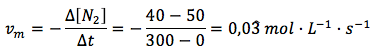
Velocidad media general en función del hidrógeno:
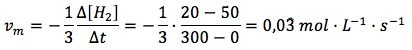
Velocidad media general en función del amoniaco:
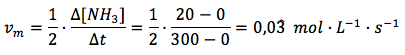
Ahora sí obtenemos el mismo valor en los tres casos. Por tanto, usando la expresión de la velocidad media general recomendada por la IUPAC, teniendo en cuenta el coeficiente estequiométrico, obtenemos el mismo resultado independientemente de cuál sea el reactivo o producto tomado como referencia.
Velocidad instantánea, v
Por último veremos otro concepto relacionado con la velocidad de reacción, que es el de velocidad instantánea. La velocidad instantánea es la velocidad que tiene la reacción química en un momento dado, y la representaremos, simplemente, con la letra v. Es, por tanto, la velocidad cuando el intervalo de tiempo considerado, Δt, es prácticamente 0, por lo que matemáticamente se puede expresar como un límite:
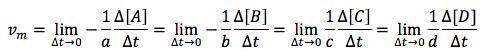
El límite cuando Δt tiende a cero equivale a la derivada de la función, es decir:
![]()
En los próximos vídeos resolveremos ejercicios aplicando dichos conceptos de velocidad de reacción y posteriormente continuaremos con los conceptos teóricos del tema de cinética química. En concreto, los dos vídeos teóricos siguientes, 3 y 4, tratan sobre la teoría de colisiones de las reacciones químicas y la teoría del complejo activado.
También te puede interesar:
Cinética Química Ejercicio 1: Velocidad media en la descomposición de PCl5
Cinética Química Ejercicio 2: Velocidad media en la oxidación de NH3
Cinética Química Ejercicio 3: Velocidad media de descomposición del H2O2
Cinética Química Ejercicio 4: Velocidad media general y velocidad instantánea
Category: Cinética Química y Teoría de Cinética Química.
Etiquetas: Velocidad de reacción.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Gracias por comenzar a subir los videos de cinética quimica era el tema que me hacia falta saludos desde Venezuela espero y sigas subiendo
Emily Montilla, 10 Años Antes
Hola Emily, gracias a ti por comentar. Espero que a lo sumo en un par de semanas esté el tema completo. Un saludo.
QuimiTube, 10 Años Antes
Excelente material. Como todos los de este sitio. Sólo marco un pequeño error en el resultado del cálculo de Vm en función de H2. Lo correcto es 0.1 mol/l.s
Gladis, 10 Años Antes
Tienes toda la razón Gladis, a veces cuando se está ante la cámara se cometen errores de los que no se es consciente. Ya lo he agregado como anotación en el vídeo. Un saludo grande.
QuimiTube, 10 Años Antes
En mi comentario anterior he obviado el signo negativo: el resultado correcto de Vm en función de H2 sería entonces -0.1 mol/l.s. Disculpas.
Gladis, 10 Años Antes
Hola,
Soy un profesor de Química de segundo de bachillerato. Tus vídeos me parecen muy interesantes y didácticos.
Pienso recomendarlos para el curso que viene a mis alumnos/as.
¡Qué pena no haberlos descubierto antes!
Saludos, y gracias por tu labor.
AGUSTIN, 9 Años Antes
Muchisimas gracias por el gran apoyo. Tengo que examinar en septiembre y ya no tengo porque preocuparme por eso, te lo agradezco un montón mil gracias .
Un abrazo y saludos. 🙂
Feri, 9 Años Antes
¡Mucha suerte! Un saludo grande y ánimo.
QuimiTube, 9 Años Antes
Muy interesante sus videos ha sido una gran ayuda ya he podido avanzar mas rapido espero q sigas suviendo mas videos okey apoyo
kerly, 9 Años Antes
Muchas gracias me alegra que te hayan servido. Un saludo.
QuimiTube, 9 Años Antes
Me encantan tus vídeos y me parecen muy didácticos y fáciles de entender, pero tengo una duda, pues en él primer ejercicio donde se daba la velocidad media en función de H2 el resultado no me da 0,01 sino 0.1. De Nuevo agradezco mucho Tia videos.
Diego, 8 Años Antes
Tienes toda la razón Diego, da 0,1, está mal el cálculo. Un saludo grande y gracias por tu comentario.
QuimiTube, 8 Años Antes
MOY BOENO ME ENCANTA QUE HAYAS DEJADO UN RESUMEN ABAJO BAH LO QUE DIJISTE EN EL VIDEO YA QUE NO TENGO GANAS DE VER EL VIDEO AH Y TE EQUIVOCASTE EN EL H ES -0,1
VAYNEE MAIIIN, 5 Años Antes
Enhorabuena por tus excelentes clases
José, 4 Años Antes
¡Muchas gracias!
QuimiTube, 4 Años Antes