Contenido del Vídeo
En este ejercicio resuelto del tema de Cinética Química calcularemos la constante de velocidad a una determinada temperatura utilizando la ecuación de Arrhenius linealizada. El enunciado es el siguiente:
La energía de activación de una reacción A+B → C es de 90 kJ/mol. La constante de velocidad a 40ºC es 10-3 mol-1·L·s-1. Calcular la constante de velocidad a 80ºC.
Para ello, como decimos, utilizaremos la ecuación de Arrhenius linealizada a cada temperatura, que es de la forma:
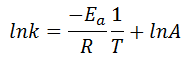
Category: Cinética Química y Ejercicios de Cinética Química.
Etiquetas: Constante de velocidad, Ecuación de Arrhenius y Energía de activación.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Hola profesora, espero que esté teniendo un excelente día, sus vídeos explicando son excelentes, me han ayudado mucho, pero quisiera saber cual es su apellido para utilizar su información en un trabajo, gracias.
Saludos.
Andrea, 10 Años Antes
Hola Andrea, muchas gracias por tu comentario. Mi apellido es Caballero. Un saludo.
QuimiTube, 10 Años Antes
profesora tengo dudas entiendo el procedimiento y lo teorico de la cinetica quimica pero no se como relizar ciertos ejercicios me podria ayuda?
ylan, 9 Años Antes
Hola Ylan, lo único que te puedo decir es que veas muchos ejercicios resueltos y practiques sin parar ejercicios similares a los resueltos… Es la única forma de que te salgan, la práctica constante y la perseverancia.
QuimiTube, 9 Años Antes
Hola, me gustaría saber como se calcula e elevado a -2,987 con la calculadora. Muchas gracias y un saludo
Víctor, 8 Años Antes
No tengo idea de cómo se calcula el ln de 10^-3 porque me sale -6,907 y al calcular el lnk2 no me da lo mismo que en el vídeo.
Vanessa Maroto Juan, 8 Años Antes
Gracias por tan buena exposicion de los temas. Pero hay algunos q no se aprecia ver bien el marcador en el pizarron.
lucy, 7 Años Antes