Contenido del Vídeo
Cuando se forma un compuesto iónico a partir de los sus iones, se desprende una gran cantidad de energía. Esta energía recibe el nombre de energía reticular. En concreto, se puede definir la energía reticular como la energía liberada cuando se forma un mol de compuesto iónico a partir de sus iones en estado gaseoso:
![]()
Cuanto mayor sea la energía liberada en el proceso, más estable será la red cristalina en cuestión.
Además de experimentalmente, dicha energía reticular se puede calcular a partir de la llamada ecuación de Born-Landé:

No obstante, esta ecuación depende de algunas constantes, como la constante de Madelung, A, o n, el coeficiente de compresibilidad, cuyos valores no siempre se conocen con precisión. Por este motivo, se puede recurrir para la determinación de la energía reticular, a un ciclo termodinámico que recibe el nombre de Ciclo de Born-Haber.
Este ciclo se basa, por así decirlo, en desglosar el proceso global en un conjunto de procesos parciales.
La reacción química global que tendrá lugar para la formación del compuesto iónico, será aquella en la que se parte de las sustancias más estables en la naturaleza (a temperatura ambiente) para los elementos que forman la red cristalina. Siguiendo con el ejemplo del cloruro sódico, la forma más estable del sodio puro en la naturaleza es el sodio metálico, sólido, Na(s). Para el cloro, la forma más estable es el cloro gaseoso diatómico, Cl2(g). La reacción será:
![]()
En esta reacción se desprende cierta cantidad de energía, debido a que el NaCl es más estable que el Na(s) y el Cl2(g) por separado. A esta energía que se desprende, la llamamos variación de entalpía de formación, concepto en el que profundizaremos en el tema de termodinámica.
Por otra parte, también hemos definido la energía reticular de la red iónica, que es generalmente lo que deseamos calcular mediante este Ciclo de Born-Haber, como la energía desprendida cuando se forma un compuesto iónico a partir de los iones en estado gaseoso:
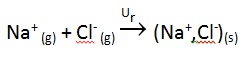
La combinación de ambas ecuaciones mediante pasos intermedios constituye el Ciclo de Born-Haber que, para este caso, se puede escribir como:
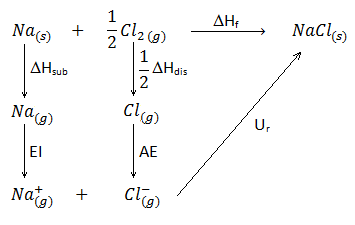
Veamos qué significan algunos de los parámetros que aparecen en este ciclo y aún no hemos comentado:
ΔHsub: entalpía de sublimación del sodio. Como inicialmente tenemos el sodio en estado sólido, y en la ecuación de la energía reticular aparece en estado gaseoso y catiónico, debemos aportar dicha energía de sublimación para pasarlo de sólido a gas.
EI: energía de ionización del sodio. Una vez que se halla en estado vapor, el sodio debe ionizarse, lo cual implica perder un electrón para quedar como catión sodio.
ΔHdis: entalpía de disociación del cloro. Puesto que el cloro se halla en forma gaseosa pero diatómica, deben romperse las moléculas de Cl2 para tener átomos gaseosos independientes. Puesto que tenemos 1/2 mol de Cl2, debemos poner también 1/2 delante de dicha entalpía (sólo necesitaremos la mitad, ya que esta energía vendrá dada en kJ/mol).
AE: afinidad electrónica del cloro. Una vez que el cloro se ha disociado y se halla como átomos individuales, pero neutros, deben captar un electrón para quedar como aniones cloro, desprendiendo una energía que conocemos como afinidad electrónica.
Todas estas variables energéticas que aparecen en esta ecuación final son fáciles de obtener y suelen estar tabuladas, por lo que podremos calcular la Ur del cristal más fácilmente que con la ecuación de Born-Landé.
Así, finalmente, a partir del Ciclo de Born-Haber podemos plantear una ecuación, ya que la energía del proceso global, ΔHf, es igual a la suma de las energías de todos los procesos parciales implicados:
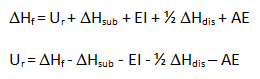
También te puede interesar el cálculo de la energía reticular a partir de la ecuación de Born-Landé.
Category: Enlace Químico y Teoría de Enlace Químico.
Etiquetas: Ciclo de Born-Haber y Enlace iónico.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Muchas gracias por el video, sin duda me servirá para mi Examen de hoy 🙂
marco, 12 Años Antes
Gracias Marco, me alegro de que te sirva y bienvenido. Mucha suerte en tu examen 🙂
QuimiTube, 12 Años Antes
Como la energia reticular es la necesaria para separar un compuesto ionico en sus dos atomos y aqui lo que estamos haciendo es ir de los atomos al cmpuesto..no deberia ser negativa la energia reticular??
daniel, 12 Años Antes
Hola Daniel, bienvenido. Sí, la energía reticular es negativa, pero no en esta fórmula en la que no hemos sustituido su valor, sino cuando lo sustituyas. Aunque en la fórmula tú veas Ur, si luego te dicen que la energía reticular es de -100 kJ/mol, tú pondrás -100, con el signo, en sustitución de Ur, no sé si me explico. A ver si pronto tengo ocasión de subir los vídeos de ejercicios resueltos ya que éste es sólo teórico.
QuimiTube, 12 Años Antes
el ciclo de born-lande no es típico en selectividad no?
alex, 12 Años Antes
Hola Alex, bienvenido. Imagino que te refieres al ciclo de Born-Haber (o a la ecuación de Born-Landé). Yo creo que el ciclo no suelen ponerlo porque resultan ejercicios bastante largos, pero dependerá de la comunidad autónoma porque cada coordinador suele tener sus preferencias. ¿De qué comunidad eres? ¿Le has echado un vistazo a los exámenes de años anteriores?
QuimiTube, 12 Años Antes
gracias por tus videos la verdad si me ayudan bastante
michael, 11 Años Antes
Gracias Michael, bienvenido.
QuimiTube, 11 Años Antes
Excelente vídeo, me ha gustado la simpleza con la que tratan al tema.
Visto de esa forma me parece fácil de aprender. Gracias.
Ángel, 11 Años Antes
Gracias Ángel, me alegra que te parezca sencillo. Un saludo.
QuimiTube, 11 Años Antes
Muchas gracias! Esta’ super bien explicado! Tu sabes si en el examen de selectividad permiten usar la table periodica? o hay que aprenderse todos los elementos de memoria asi como su ubicacion para llegar a saber todos los datos que necesitamos para hacer las ecuaciones?
annalisa, 11 Años Antes
¡Hola! Muchas gracias, me alegra que te sirva 🙂 Pues creo que depende de la comunidad autónoma, en la mía (Baleares) sí que te dan una tabla periódica con los símbolos, el número atómico y la masa atómica. Creo que es así en la mayoría, es muy raro que pretendan que te sepas toda la tabla periódica de memoria… ¿En qué comunidad te examinas? Un saludo.
QuimiTube, 11 Años Antes
en la de Madrid. Me quedo mucho mas tranquila sabiendo eso! Enhorabuena por tu trabajo, me estas ayudando muchissimo con los videos, mil veces mas claros que los libros de texto. Gracias!
annalisa, 11 Años Antes
Si te surge cualquier duda del contenido, ya sabes, puedes consultar… Te comentaré si me entero de lo de la tabla periódica en Madrid, pero juraría que te la deben dar. Un saludo.
QuimiTube, 11 Años Antes
Muchas gracias!!
annalisa, 11 Años Antes
Excelente material, muchas gracias muy buena explicación.
Fernando, 11 Años Antes
Muchas gracias y bienvenido, Fernando.
QuimiTube, 11 Años Antes
Hola, una consulta en el ciclo de born haber, como se determina si el compuesto sera o no estable? Puede ser q sea por la energía reticular, si es q supera o no el cero?
daniel, 11 Años Antes
Por que solo se llega a la primera energia de ionización y afinidad electrónica? Hay ejercicios que llegas a la segunda…
Juan Luis, 11 Años Antes
Hola Juan Luis. Porque hemos utilizado el cloruro sódico como ejemplo para explicar la teoría y solo tienes una, pero tienes otros vídeos con ejercicios resueltos en los que efectivamente llegas a la segunda en uno o en ambos iones. Aquí verás todos los ejercicios resueltos que hay sobre Born-Haber:
http://www.quimitube.com/videostags/ciclo-de-born-haber/
QuimiTube, 11 Años Antes
Gracias me ayudo muchoooooo –d(n_n)b—
estreya, 11 Años Antes
Muy claro el video. Tengo una consulta, qué otro valor es también negativo además de la Ur?
Florencia, 11 Años Antes
En el caso de los no metales, suele ser también negativa la afinidad electrónica, ya que la captación de un electrón es un proceso favorable y se trata de energía desprendida. En todo proceso energéticamente favorable tomaremos el valor como negativo. Un saludo.
QuimiTube, 11 Años Antes
Hola, muchísimas gracias por el vídeo me ha ayudado a entender genial el ciclo para calcular la energía reticular, me servirá mucho para el examen !
belen, 11 Años Antes
De nada, me alegra que te haya servido, ¡suerte con tu examen!
QuimiTube, 11 Años Antes
muy bueno el video y muy bien explicado. nunca pongo comentarios, pero me ha hecho sentirme obligado a ello. me habeis salvado el examen. muchas gracias!
Angel, 11 Años Antes
Hola Ángel, te agradezco mucho que te hayas tomado un momento para dejar un comentario, anima mucho para continuar y saber qué tal lo estamos haciendo. Un saludo grande.
QuimiTube, 11 Años Antes
Muy interesante, una pregunta. Es posible que la reacción se hubiera dado de:
Na+ + Cl- = NaCl ?
en lugar de:
Na(s) + 1/2Cl2(g) = NaCl
Saludos y gracias por todo
Luis, 10 Años Antes
¡Hola Luis! Aunque estrictamente no es incorrecto que escribas Na+ + Cl-, diríamos que esta es la fase final, cuando el sodio ya está en forma catiónica y el cloro en forma aniónica. Pero para plantear el ciclo de Born-Haber siempre debes partir del metal en estado sólido y del no metal en su estado normal, que en el caso del cloro es Cl2. Un saludo grande y gracias por tu comentario.
QuimiTube, 10 Años Antes
Hola gracias por responder. Estuve calculando por los dos lados:
1. Na(s) + 1/2Cl2(g) = NaCl deltaH f = -411,120 KJ/mol
2. Na+ + Cl- = NaCl deltaH f = -3,741 KJ/mol
1. Na(s) + 1/2Cl2(g) = NaCl deltaH f = -411,120 KJ/mol
KJ/mol KJ/mol Uo = -786,508 KJ/mol
609,341 -233,953
Na+(g) + Cl-(g)
2. Na+ + Cl- = NaCl deltaH f = -3,741 KJ/mol
KJ/mol KJ/mol Uo = -786,509 KJ/mol
849,641 -66,873
Na+(g) + Cl-(g)
También lo probé con otras especies como (Na, K, Rb, Cs)(Cl, I, F) y resulto que cada resultado concordaba.
Debido a la ley de Hess es como si el ciclo 2 esta contenido en el ciclo 1.
Dime estoy bien.
Gracias y saludos
Luis, 10 Años Antes
Hola! no entiendo por qué la descomposición de un sólido en iones gaseosos es un proceso inverso al de la energia de red y por eso el cambio de entalpía de red es negativo. Gracias
Carla Don, 10 Años Antes
Hola Carla, fíjate que cuando escribimos el proceso de formación de la red partimos de los átomos en estado fundamental y gaseoso, y vamos añadiendo distintos procesos hasta que se forma la red sólida. Por este motivo, el proceso estrictamente inverso es pasar del sólido a los átomos en estado fundamental y gaseoso, siguiendo los mismos pasos. La energía de red la podemos poner negativa si consideramos la formación del cristal, en la cual se desprende energía.
QuimiTube, 10 Años Antes
excelente explicación 😀
mirella, 10 Años Antes
¡Gracias!
QuimiTube, 10 Años Antes
Explicación perfecta. Muchas gracias me sirvió de ayuda.
Zeida, 9 Años Antes
Hola Zeida, me alegra que te sirviera. Un saludo.
QuimiTube, 9 Años Antes
Le agradezco un mundo su página es muy útil. 😀
Henry, 9 Años Antes
Una duda, la energia reticular es solo para el enlace ionico o para el enlace quimico en general?
Si solo es para el ionico, entonces la conocida grafica de las energias atractivas y repulsivas que luego sale una curva apartir de ella dos es solo para ionico o para todos los enlaces?
Espero haberme explicado es una duda para los temas de teoria de oposicion de fyq
Muchas gracias!
Maria, 8 Años Antes
¡Hola Maria! La energía reticular es solo para el enlace iónico, aunque la curva que comentas creo que es esta, la curva de Morse:
http://www.quimitube.com/videos/enlace-quimico-curvas-de-estabilidad-energetica-o-curvas-de-morse
Y se suele aplicar para el enlace covalente porque solo considera un enlace entre dos átomos A-B, pero realmente es aplicable a cualquier sistema teórico de 2 átomos de modo que entiendo que también podría ser válido para iones
Un saludo y mucha suerte con tu oposición!
QuimiTube, 8 Años Antes
Muchas gracias por contestarme!! Siento la tardanza estuve muy liada.
Pues yo pensaba que la curva de morse por lo que vi en internet era algo asi como la explicacion grafica del enlace ionico puesto que habla de una fuerza atractiva y otra repulsiva que asocie a los iones positivo y negativo del enlace ionico. Entonces crees que es solo para el covalente?
Por lo tanto, entonces solo puedo hablar de fuerzas atractivas y repulsivas al formarse el enlace en el covalente que es el que tiene asociada la curva de morse? O tb existen esas fuerzas en el ionico??
Respecto a las fuerzas intermoleculares he leido que tambien entre las moleculas se poroducen fuerazas similares, de largo alcance atractivas y de corto repulsivas, es asi?
Por otro lado hay otra grafica igual por lo menos cualitativamente llamada de Born-Landee que hace referencia a la fuerza intermolecular entre dos moleculas. Es correcto que esa grafica haga referencia a las fuerzas interm? O igual yo lo he buscado mal? Porque eso es lo que he encontrado
Agradeceria mucho si pudieras echarme una mano porque como ves tengo bastante lio, muchisimas gracias de antemano!!!
Maria, 8 Años Antes
Excelente video, muy concreto y bastante ilustrativo.
Una pregunta enorme: cómo saber la configuración electrónica de un elemento con energías de ionización?
luis, 8 Años Antes
Hola Luis, muchas gracias. Si te fijas en los valores de energía de ionización, hay un patrón. Los alcalinos son los que tienen valores más bajos porque resulta más fácil arrancar su único electrón de valencia.
Aquí tienes los valores:
https://es.wikipedia.org/wiki/Energ%C3%ADa_de_ionizaci%C3%B3n
Tal vez si en un ejercicio te dan una serie de valores del mismo periodo y te piden qué configuraciones electrónicas cabe esperar, puedes asociar cada valor de energía de ionización a un elemento y de ahí tener su configuración.
Espero que sea esto lo que me preguntabas. Un saludo.
QuimiTube, 8 Años Antes
Tengo una duda de este tema, que diferencia hay entre atomización y disociación? Porque me encontré con ciclos de born haber que tienen como primer paso atomizar un mol del compuesto y dice entalpía de atomización
Francisco, 8 Años Antes
Bueno, yo entiendo que la disociación es un tiempo concreto de atomización en la que partes de moléculas diatómicas, pero que podrías atomizar un compuesto que no parta de moléculas diatómicas sino de otra estructura más compleja y el proceso también sería una atomización. También se me ocurre que pueda estar haciendo referencia al proceso de pasar, como en el caso concreto de este ejercicio, de sodio sólido a sodio gaseoso, que también es una atomización. Un saludo.
QuimiTube, 4 Años Antes
¿Que significa que el valor de la entalpia de formación o de la energía reticular sea negativo o muy alto?
¿Tiene algo que ver con la existencia de este compuesto en la naturaleza o no?
Jaime, 8 Años Antes
Hola Jaime, cuanta más energía se desprende en la formación de un compuesto, más estable es. Por tanto, si su entalpía de formación o su energía reticular son muy negativas, es probable que exista en la naturaleza por su estabilidad, aunque para considerar si el proceso es termodinámicamente favorable o no tenemos que mirar en conjunto entalpía y entropía, es decir, la energía libre de Gibbs. Un saludo.
QuimiTube, 8 Años Antes
ah idò
merci!
jordi, 7 Años Antes
Hola:
Podrías verificarme cuales son los elementos gaseosos diatómicos en condiciones estándar ?.
Yo creo que son : Oxígeno, Hidrógeno, Nitrógeno, Flúor y Cloro.
No sé si falta alguno o si sobra.
Muchas gracias y recibe un cordial saludo.
Javier, 7 Años Antes
¡Hola! Sobrar no sobra ninguno y faltar… Ahora mismo no se me ocurre. Otros diatómicos, como bromo y yodo, no son gases sino líquido y sólido respectivamente…
QuimiTube, 4 Años Antes
Quería saber como calcular la energía reticular del yoduro potásico, muchas gracias ?
Mariam Merini Palanco, 7 Años Antes
¡Hola! Lo podrías hacer exactamente igual que en este vídeo, pero necesitarás que te den todos los datos que requerimos, como la energía de ionización, la afinidad electrónica… o bien buscarlas en tablas… el proceso es como lo explicamos aquí.
QuimiTube, 4 Años Antes