Contenido del Vídeo
Ya hemos visto que cuando se forma un compuesto iónico a partir de los sus iones, se desprende una gran cantidad de energía. Esta energía recibe el nombre de energía reticular. En concreto, se puede definir la energía reticular como la energía liberada cuando se forma un mol de compuesto iónico a partir de sus iones en estado gaseoso:
![]()
Cuanto mayor sea la energía liberada en el proceso, más estable será la red cristalina en cuestión. Por ejemplo, los siguientes compuestos iónicos están dispuestos en orden creciente de estabilidad:
Energía reticular del cloruro sódico, NaCl = -767 kJ/mol
Energía reticular del fluoruro potásico, KF = -802 kJ/mol
Energía reticular del fluoruro de litio, LiF = -1007 kJ/mol
Aunque la energía reticular se pude determinar experimentalmente, también se puede calcular a partir de una relación matemática, la ecuación de Born Landé, que tiene en cuenta una serie de parámetros cristalinos. Esta ecuación es:

Algunos de estos parámetros, como la constante de Madelung o el coeficiente de Born, no son fáciles de determinar con precisión. Por esto motivo, esta ecuación es más útil si lo que deseamos es únicamente realizar un estudio comparativo de la estabilidad de 2 compuestos iónicos, de forma cualitativa. Así, basta que observemos en la relación carga-radio, que son los parámetros más determinantes en el valor de la energía reticular. De esta forma, la energía reticular es directamente proporcional al producto de carga de los iones e inversamente proporcional a la distancia que los separa:
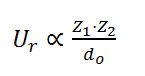
- Efecto de la distancia internuclear. Cuanto más grande sea la distancia entre los iones, menor será la energía reticular y menos estable será el cristal iónico formado. Por el contrario, cuanto más pequeños sean los iones y, por tanto, más se aproximen, mayor será la energía reticular. Por ejemplo, si comparamos la energía reticular para dos compuestos en los que sólo cambia el tamaño del anión, tenemos:
Energía reticular del cloruro sódico, NaCl = -767 kJ/mol
Energía reticular del fluoruro sódico, NaF = -910 kJ/mol
Vemos que el fluoruro sódico, cuyos iones están más próximos entre sí porque el fluoruro es más pequeño que el cloruro (puedes revisar si quieres la variación periódica del radio atómico) tiene una energía reticular mayor que el cloruro sódico (desprende más energía al formarse) y por tanto es más estable.
- Efecto del producto de cargas. Cuanto mayor es el producto de cargas, mayor es la energía reticular desprendida y mayor la estabilidad de la red. Si comparamos dos compuestos en los que cambia la carga del catión, tendremos:
Energía reticular del cloruro sódico, NaCl (producto de cargas 1) = -767 kJ/mol
Energía reticular del cloruro de magnesio, MgCl2 (producto de cargas 2) = -2326 kJ/mol
Por tanto, cuanto mayor es la carga de los iones, más grande es la fuerza de atracción electrostática entre los mismos y por ello es mayor la energía reticular.
A mayor energía reticular de un compuesto, más difícil será fundirlo, evaporarlo o rayarlo.
Así, cuando debamos comparar la estabilidad relativa de varios compuestos iónicos, como veremos en los ejercicios, lo haremos considerando este hecho, que la energía reticular es proporcional al producto de cargas e inversamente proporcional a la distancia internuclear.
También te puede interesar el cálculo de la energía reticular a partir del Ciclo de Born-Haber.
Category: Enlace Químico y Teoría de Enlace Químico.
Etiquetas: Ecuación de Born-Landé y Enlace iónico.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
Hola!
No tienes ningun video que expliques estequiometria? concentracion de disolucion, volumen, desidad, ajuste de equaciones y todas esas cosas?
🙂
didi, 12 Años Antes
¡Hola! No, la verdad es que todavía no tengo nada sobre disoluciones ni concentraciones, como máximo algunos cálculos estequiométricos posteriores al ajuste de reacciones redox o en ácido base. Más delante los añadiremos… De todas formas puedes preguntar las dudas que tengas al respecto, aunque no haya ningún vídeo… Un saludo enorme 🙂
QuimiTube, 12 Años Antes
Que bien explicados están los temas!
gracias por la ayuda
Usuario, 12 Años Antes
Gracias, me alegro de que te gusten 🙂 A ver si pronto, en unas semanas, tengo ocasión de continuar subiendo material nuevo para completar el curso. Un saludo.
QuimiTube, 12 Años Antes
Holaa! tengo una pregunta sobre este tema que es:
Entre los sólidos cristalinos ( LiCl, LiBr y LiF) ¿ como puedo averiguar cual es el compuesto con mayor energía reticular? ¿y el que tiene menor punto de fusión?
(en otro ejercicio igual lo hice por el producto de las cargas, pero en este caso son todos iguales)
Ricardo, 12 Años Antes
Hola Ricardo, bienvenido. Fíjate en el pie de vídeo, donde están explicados los dos efectos: por una parte el producto de cargas, como tú comentas, y por otro lado la distancia internuclear. Ahí hemos puesto el ejemplo del NaCl y del NaF, que será muy semejante a lo que tú planteas. Cuanto más cerca se hallan los iones (y por tanto menor es su radio) están atraídos con más fuerza y por tanto su energía reticular es mayor, así como su punto de fusión. En tu caso, el F- es el más pequeño y el Br- el más grande.
QuimiTube, 12 Años Antes
Hola, antes de nada, darte las gracias por la extraordinaria labor que haces, los vídeos son magníficos, el temario está ordenado y las explicaciones son muy claras, de verdad que eres un apoyo crucial en mi estudio.
Mi duda venía al hilo de la de Ricardo, ciertamente entiendo como valoras las energías de red entre los elementos que él plantea (LiCl, LiBr y LiF), a partir de los radios atómicos, del mismo modo que lo haces en el propio vídeo con NaCl y NaF. Sin embargo no entiendo por que en vez de hacerlo así no se puede elegir el otro método que explicas en el vídeo después: comparando cargas, ya que en el vídeo también lo haces con moléculas que tienen un solo átomo diferenciador (Cl en MgCl2 y NaCl2). En principio pensé que el método de estudio era indiferente, pero en realidad en el ejemplo del vídeo las conclusiones que obtendríamos serían opuestas ya que el producto de cargas en NaCl sería superior al de NaF, mientras que el radio de F es menor al de Cl por tanto comparando las cargas concluiríamos que la energía de red de NaCl es mayor a la de NaF, y si comparamos radios sería justo a la inversa.
Esto me hace pensar que el método de comparación cualitativa de Born-Landé para las cargas quizás solo sirva para elementos que además de diferenciarse en un solo átomo, además éste esté en en el mismo periodo (así podríamos suponer que dicho átomo diferenciador tiene un radio iónico muy similar), como de hecho ocurre en el ejemplo que tu planteas (Na y Mg están ambos en el periodo 3, en ese periodo podemos suponer que el radio iónico es similar y lo más representativo es la carga), no se si estoy en lo cierto, y aún así no se cuando debería utilizar el de comparación de radios…
¿Puedes ayudarme? 🙂
Mario, 12 Años Antes
¡Hola Mario! Me parece que te has autocomplicado la vida jejeje… Siempre vas a poder utilizar la ecuación de Born-Landé, tanto si la diferencia está en los radios como si está en las cargas. Lo que ocurre es que en NaF y NaCl sí que tienes el mismo producto de cargas, no es superior en NaCl, y ahí está tu error. El sodio es un catión monovalente, Na+, y el fluoruro y el cloruro aniones monovalentes, F- y Cl-, por lo que ambos compuestos tienen un producto de cargas |Z1·Z2| en valor absoluto = 1, y por cargas en este caso no podrás diferenciarlos. Lo mismo ocurre con LiCl, LiBr y LiF, y por eso recurrimos a los radios. No obstante, podrás tener otros ejercicios en los que el criterio diferenciador sea tanto de cargas como de radios, por ejemplo:
http://www.quimitube.com/videos/enlace-quimico-ejercicio-26-ordenar-de-mayor-a-menor-energia-reticular-ki-cas-kf-y-cao/
QuimiTube, 11 Años Antes
Yo no entiendo lo del ejemplo de NaCl y NaF, ósea por que el F está más unido ?
Celia, 11 Años Antes
Porque el F- es más pequeño y está más cerca del Na+, así que su fuerza de interacción es más intensa que en NaCl. Fíjate que la distancia entre iones está en el denominador de la fórmula; cuanto más pequeña sea, más grande es la energía reticular del compuesto.
Te puede servir ver este ejercicio:
http://www.quimitube.com/videos/enlace-quimico-ejercicio-25-energia-reticular-y-punto-de-fusion-de-naf-kf-lif-y-naf-nacl-nabr/
Un saludo
QuimiTube, 11 Años Antes
Empezar diciendo que tus videos me estan ayudando un monton con todas mis dudas de quimica, asique muchas gracias por todo lo que me has ayudado ya.
Pero tengo una pregunta que todavia no se solucionar…me piden que:
Calcule la energía reticular del cloruro de talio mediante el ciclo de Born-Haber. Compare el resultado con el obtenido mediante la ecuación de Born-Landé e indique el origen de las discrepancias.
y me dan estos datos:
Distancia interiónica = 3.31 Å
A = 1.7627, n = 10.5
ΔHf(TlCl(s)) = -161.8 kJ/mol
Energía de ionización del Tl = 6.1 eV
ΔHsublimación (Tl(s)) = 41 kcal/mol
Afinidad electrónica del Cl = -83.5 kcal/mol
Energía de disociación del Cl2 = 59 kcal/mol
Como esperan que lo haga si la constante de madelung y la cte de born no se pueden calcular??….
Muchisimas gracias
Paula, 11 Años Antes
Hola Paula, muchas gracias por tu comentario, me alegra que te sirvan los vídeos 🙂
Pero en los datos que indicas sí que te dan la constante de Madelung y de Born, A = 1,7627 y n = 10,5, no sé si te falta algún otro dato pero creo que no, me parece que lo podrás calcular todo…
QuimiTube, 11 Años Antes
tienes razón haha…es que soy un poco despistada. Si me puedes ayudar en una ultima cosa… el porque de sus discrepancias? supongo que será por lo que tu dices que es muy complicado calcular la cte de madelung y de born y por lo tanto la energia reticular calculada por el cuclo de born es mucho mas precisa que cuando la calclamos por la ecuacion de born-lande?
Muchas gracias 🙂
Paula, 11 Años Antes
No te preocupes, yo también soy despistada 🙂
Sí, yo creo que esa respuesta es correcta.
QuimiTube, 11 Años Antes
Calcule la energía reticular del cloruro de calcio dado que el calor
de sublimación del Ca es 121 kJ/mol y (Hf°( CaCl2) =-795 kJ/mol. (Para más
datos, véanse tablas 8.2 y 8.3)
Como puedo resolver este ejercicio
Deret, 10 Años Antes
Ante todo hola, buenas tardes. Para resolver este ejercicio te sugiero que lo hagas con el ciclo de Born-Haber:
http://www.quimitube.com/videos/enlace-quimico-ejercicio-28-calculo-de-la-energia-reticular-del-fluoruro-de-calcio-caf2-por-born-haber-y-born-lande
Este que te indico es para el fluoruro de calcio, muy similar al del cloruro de calcio ya que tanto flúor como cloro son halógenos, que se encuentran en estado gaseoso a temperatura ambiente.
Un saludo.
QuimiTube, 10 Años Antes
gracias, saludos y ya casi buenas tardes
Deret, 10 Años Antes
Sí, donde yo estoy casi buenas noches, son las 19:35 🙂 Un saludo grande.
QuimiTube, 10 Años Antes
Ante todo decirte, aunque me repita, que tus videos son utilisimos y estan perfectisimamente explicados.
Solo dos comentarios: en el caso del MgCl2 yo creo que el producto de cargas es 4 el lugar de dos como y
cuando escribes Ur (MgCl2) > Ur(NaCl), sin embargo -2326 < -767 KJ/mol.
Muchisimas gracias.
Jose Luis Coll Davila, 10 Años Antes
¡Hola! Muchísimas gracias por tu comentario, me alegra que los vídeos te resulten útiles porque es su finalidad. No sería 4 porque tienes que tener en cuenta la carga del catión y la del anión, sin importar la estequiometría en sí. El magnesio tiene carga +2, y el cloruro -1, de modo que su producto, en valor absoluto, es 2 y no 4. Sería 4 si tuvieses otro compuestos como por ejemplo el MgO, en el que el Mg seguiría teniendo carga +2 y el oxígeno -2, y el producto global sería 4 en valor absoluto.
Por otra parte, en cuanto a lo del signo, es cierto que puede generar algo de confusión y pido disculpas. Lo pongo de ese modo en realidad considerando valores absolutos y debería poner !U(MgCl2! > !U(NaCl)!. La idea es indicar que el cloruro de magnesio es un compuesto con mayor dureza que el cloruro sódico porque cuando se forma un mol del mismo se desprende una mayor cantidad de energía.
Un saludo grande.
QuimiTube, 10 Años Antes
OK perfecto, gracias por tu aclaración, pues tenía yo un error de concepto.
Por cierto, para poder mencionar tu nombre en nuestros comentarios, como te llamas???
Salu2
J. L. Coll
Jose Luis Coll, 10 Años Antes
Hola José Luis, disculpa la tardanza, en ocasiones tengo algún problema con la moderación de comentarios. Mi nombre es Carmen. Un saludo grande.
QuimiTube, 10 Años Antes
Gracias a tu excelente explicacion del calculo de Energia reticular y los ciclos de Born Haber, aprobe mi examen de quimica. Eternamente agradecido.
Pablo, 10 Años Antes
Hola Pablo, enhorabuena, me alegra muchísimo que aprobaras tu examen y que te sirvieran nuestros contenidos. Un saludo grande.
QuimiTube, 10 Años Antes
Hola tus vídeos son buenísimos y me han ayudado mucho, sin embargo no he podido calcular el radio iónico de un compuesto a partir de la energía reticular
Daniela, 9 Años Antes
¡Hola Daniela! ¿Tenías todos los parámetros necesario para sustituir en la ecuación? Con esta misma, la de Born-Landé, puedes hacerlo, ya que te calcula la energía reticular en función de la distancia que separa los iones.
QuimiTube, 9 Años Antes
hola tus videos son buenisimos pero seria bueno un video donde expliques como calcular la afinidad protonica apartir del ciclo de born haber
paola vasquez, 8 Años Antes
¡Hola Paola! Muchas gracias por tu comentario. Esos contenidos son de nivel universitario y de momento no los vamos a desarrollar… Un saludo grande.
QuimiTube, 8 Años Antes
Justo lo que buscaba, muchas gracias!
Carlos, 8 Años Antes
Me alegra que te sirviera, un saludo.
QuimiTube, 8 Años Antes