Contenido del Vídeo
En este ejercicio del tema de cinética química, calcularemos la energía de activación de una reacción a partir de la relación entre las constantes de velocidad a dos temperaturas distintas. El enunciado completo es el siguiente:
La velocidad de una reacción química se multiplica por 4 cuando pasamos de 290 a 312K. ¿Cuál es su energía de activación?
Para poder realizar este cálculo haremos uso de la ecuación de Arrhenius linealizada:
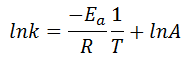
También te puede interesar:
Cinética Química Teoría 8: Ecuación de Arrhenius
Cinética Química Ejercicio 16: Calcular la constante de velocidad con la ecuación de Arrhenius
Category: Cinética Química y Ejercicios de Cinética Química.
Etiquetas: Ecuación de Arrhenius y Energía de activación.





 Estructura Atómica
Estructura Atómica Enlace Químico
Enlace Químico Termodinámica química
Termodinámica química Equilibrio Químico
Equilibrio Químico Ácido Base
Ácido Base Redox
Redox Selectividad
Selectividad
hola tengo una duda por que en el vídeo 16 de cinética química restas lnK2-LnK1 y en este es al revés LnK1-LnK2 depende de lo que quieras sacar?
MARCELINO, 10 Años Antes
¡Hola! No, no importa cómo lo hagas, el resultado será el mismo porque solo es un «trámite» matemático. Un saludo grande.
QuimiTube, 10 Años Antes
¿Cómo se averigua la energía de activación inversa en una reacción?
Reyes, 10 Años Antes
¡Hola! La energía de activación directa es la diferencia entre el pico de máxima energía (el estado de transición) y los reactivos, ¿verdad? Pues en el caso de la inversa es lo mismo con los productos, es decir, el estado de transición menos la energía de los productos. Un saludo.
QuimiTube, 9 Años Antes
Saludos! Lo explicas sencillo y al detalle, esplendido trabajo!
luis, 9 Años Antes
¡Gracias!
QuimiTube, 9 Años Antes