Utilización del calorímetro en laboratorio para determinar la variación de entalpía de neutralización
Escrito por Quimitube el 7 agosto
Como sabrás, existe una rama de la química (la termoquímica o termodinámica) que estudia la energía implicada en las reacciones químicas y, dentro de esta energía, estudia el calor de reacción a presión constante, lo que conocemos con el nombre de entalpía de reacción. Habrás visto con frecuencia reacciones químicas donde aparece lo siguiente:
Equilibrio químico entre el nitrógeno y el hidrógeno para producir amoníaco
Pues bien, esta variación de entalpía que en el caso de esta reacción en concreto es de -94,2 kJ (para 2 moles producidos de amoníaco), para ésta y otras reacciones, es un valor tabulado que se ha determinado generalmente de forma experimental. Aunque existen métodos sofisticados, una forma sencilla de medir el calor de reacción a presión constante en el laboratorio es mediante el uso de un calorímetro, un aparato muy semejante a un termo para mantener caliente el té o el café, es decir, un recipiente que posibilita que la pérdida de calor durante el proceso sea pequeña.
Mediante un calorímetro, además de medir el calor que se libera o absorbe en una reacción química, se puede determinar la capacidad calorífica específica de una sustancia.
El calorímetro consiste esencialmente en un vaso metálico protegido por otro vaso de material aislante para evitar intercambios de calor con el entorno. El recipiente dispone de una tapa perforada donde colocamos un termómetro (debemos medir la variación de temperatura durante la reacción química) y un agitador. A continuación vemos un esquema:
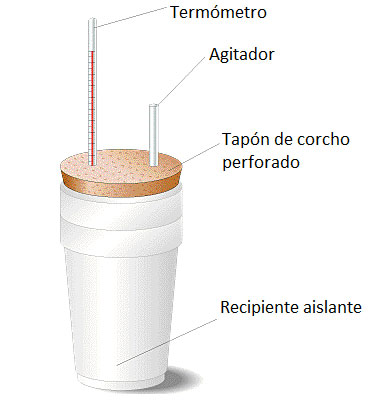
Esquema de un calorímetro sencillo de laboratorio
Si, por ejemplo, queremos determinar la variación de entalpía de la reacción de neutralización entre el ácido clorhídrico y el hidróxido sódico, según la reacción:
Reacción de neutralización ácido clorhídrico – hidróxido sódico
Se prepara cierto volumen de ambas disoluciones de la misma concentración, por ejemplo, 250 ml de una disolución de HCl 0,5M y 250 ml de disolución de NaOH 0,5M. Cuando las dos disoluciones están a temperatura ambiente (la temperatura es esencial en este experimento, ya que calcularemos la variación de entalpía por variaciones en la temperatura), anotaremos dicha temperatura. Lo adecuado en un laboratorio es tener una temperatura ambiente entre 15 y 25ºC. Seguidamente mezclamos volúmenes iguales y exactos de las dos disoluciones dentro del calorímetro, cerramos rápidamente y controlamos la temperatura, anotando el valor máximo que ésta alcanza.
La reacción de neutralización ácido-base es fuertemente exotérmica (si no tuviésemos el protector aislante del calorímetro notaríamos que el recipiente se calienta mucho) el calor desprendido es absorbido por la propia disolución, motivo por el cuál sube su temperatura, y otra porción de calor es absorbido por el propio calorímetro. La cantidad de calor que absorberá la disolución vendrá dada por su masa y su capacidad calorífica específica:
Intercambio de calor en el calorímetro
Si las disoluciones empleadas son relativamente diluidas, podemos asemejar el valor de c a la capacidad calorífica específica del agua, que es 4180 J/kg·K, del mismo modo que podemos ignorar el error por pérdida de calor debida a la absorción por el calorímetro si éste tiene una masa pequeña y el valor de calor que absorbe es pequeño a su vez.
Una vez calculado el calor de reacción, q, para nuestras condiciones, podemos determinar la variación de entalpía para cada mol de NaOH o para cada mol de HCl que ha reaccionado.
Como se puede observar, la determinación experimental de una entalpía de reacción en el laboratorio es muy sencilla.





Información Bitacoras.com…
Esta anotación ha sido propuesta por un usuario para ser votada en Bitacoras.com. Para que el proceso finalice, deberás registrar tu blog en el servicio….
Bitacoras.com, 12 Años Antes
q lleva exactamente de matriales
Elver Gudo, 11 Años Antes
¡Hola! El calorímetro lleva simplemente un vaso térmico (como el de guardar el café para que se mantenga caliente) y una carcasa de plástico. Ambas están perforadas para poder introducir un termómetro o una sonda de temperatura, y dentro introduces las disoluciones.
QuimiTube, 11 Años Antes
tu pagina me ha salvado la vida en innumerables ocasiones eres la mejor 😀 saludos desde venezuela
Ever, 10 Años Antes
¡Muchísimas gracias! Un abrazo grande.
QuimiTube, 10 Años Antes
como podemos calibrar el calorimetro para saber ademas el calor que pierde la reaccion, cuando lo mide el termometro? ya se que es muy pequeño ese calor pero querria saber como
pablo, 10 Años Antes
Hola Pablo, se hace poniendo una determinada cantidad de agua dentro del calorímetro a temperatura ambiente (medimos la temperatura exacta) y luego mezclamos con otra cantidad conocida de agua caliente (también medimos la cantidad de agua exacta y la temperatura del agua antes de mezclar). Una vez mezcladas ambas, determinamos la temperatura final, que se desviará de la temperatura de equilibrio por el equivalente de agua del calorímetro (es decir, lo que el calorímetro absorbe). Aquí tienes un applet que está muy bien para esto y también te muestra la fórmula a emplear:
http://teleformacion.edu.aytolacoruna.es/FISICA/document/fisicaInteractiva/Calor/Med_CalEspec/calorEspecFranco/AppletMedidaCe.htm
Un saludo
QuimiTube, 10 Años Antes
Muy buena la explicacion gracis por todo
saida, 9 Años Antes
¡De nada!
QuimiTube, 9 Años Antes
Hola primero que nada quiero decirte que tus vídeos y tu pagina me han ayudado muchísimo, gracias por ello! y en segundo término quisiera que me resolvieras una duda, ya que hice una experiencia en el laboratorio para determinar la entalpía de neutralizacion entre un ácido y una base fuerte (con los mismo reactivos que haces el ejemplo anteriormente HCl y NaOH) pero al momento de sacar los cálculos la entalpía me dio un valor de 14,011 kcal/molH2O al compararla con el valor teórico (13,68 kcal) esto arroja un error por exceso de 2,41% mi duda es cual seria la causa de esto? espero pueda ayudarme muchisimas gracias de antemano, feliz día saludos desde venezuela
Alexandra, 9 Años Antes
¡Hola Alexandra! El error no me parece excesivo para ser un cálculo experimental, está bastante bien. Normalmente el erro en el laboratorio se debe a que la temperatura no es exactamente la misma que la de referencia (a lo mejor el valor es a 25º y tú tenías 24, por ejemplo) y también a la absorción de calor por parte de los materiales del calorímetro y a la no hermeticidad del recipiente, haciendo que cierta cantidad de calor se haya «fugado» y no haya aumentado la temperatura de la mezcla, dándote un valor inferior al calor real desprendido en la reacción.
QuimiTube, 9 Años Antes