Reacción entre el bromo y el aluminio: fuego por un tubo
Escrito por Quimitube el 15 diciembre
En una entrada anterior vimos la reacción producida entre un halógeno, el yodo, y el metal aluminio. Esta se trata de una reacción fuertemente exotérmica y muy llamativa. En esta ocasión traemos una reacción muy similar, ya que se trata de la reacción entre otro halógeno, el bromo, y el aluminio. A diferencia del yodo, que es un sólido a temperatura ambiente (por su mayor masa molecular) el bromo, como moléculas diatómicas de Br2, se presenta en forma líquida. Por este motivo, veremos que la reacción se lleva a cabo en un tubo de ensayo. Es tan violenta que el fuego sale por la boca del tubo, y este es el motivo por el que he querido compartir con vosotros este vídeo. Aunque la reacción es, en esencia, muy similar a la anterior, no deja de ser impresionante observarla:
Durante la reacción tiene lugar un desprendimiento de vapores. Se trata de vapores de bromo, cuyo punto de ebullición es de 59ºC, que es capaz de evaporarse porque la reacción producida es altamente exotérmica y aumenta muchísimo la temperatura en el tubo de ensayo. También están presentes vapores de bromuro de aluminio, el producto de reacción, cuyo punto de ebullición es mucho más bajo, de -8ºC.
Se trata de una reacción de oxidación reducción, ya que el bromo molecular es un buen oxidante y el aluminio metálico es un buen reductor. Tendremos:
Semirreacción de oxidación del aluminio:
En esta reacción, el aluminio se oxida, pasando de un estado de oxidación 0 a un estado de oxidación +3.
Al0 → Al3+ + 3e
Podemos observar su potencial estándar de reducción en una tabla de potenciales, que es:
Eo = -1,67 V
Semirreacción de reducción del bromo:
En esta reacción, el bromo se reduce, pasando de un estado de oxidación 0 a un estado de oxidación -1.
Br2 + 2e → 2Br–
Eo = 1,06 V
Reacción final ajustada:
2Al0 + 3Br2 → 2Al3+ + 6Br–
2Al0 + 3Br2 → 2AlBr3
Globalmente, la reacción tendrá un potencial estándar que podemos calcular de la siguiente forma:
Eo = Eo reducción – Eo oxidación
Eo = 1,06 – (-1,67) = + 2,73 V
Sin embargo, habrá que tener en cuenta que las condiciones en las que se realiza la reacción no son exactamente las mismas que las consideradas en la tabla de potenciales (concentración, temperatura…) y que, por tanto, este valor será aproximado. Aun así, nos sirve sin duda para ver que, efectivamente, obtenemos un potencial estándar de reacción positivo, muy positivo, lo cual implica que la reacción es espontánea (energía libre de Gibbs negativa) como efectivamente podemos ver en el vídeo. No solo es espontánea (termodinámicamente favorable) sino también veloz (cinéticamente favorable).
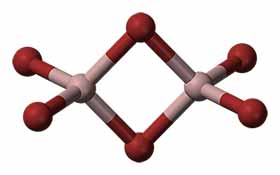
El producto obtenido, el tribromuro de aluminio, es un producto irritante, por lo que se trata de una reacción poco recomendable y no se debe realizar sin las medidas de seguridad oportunas. Aunque lo hemos escrito con la estequiometría AlBr3, en realidad a este compuesto le ocurre como al yoduro de aluminio: tiene tendencia a dimerizar y formar una especie, más habitualmente, de estequiometría Al2Br6, cuya estructura es la siguiente:
Referencias:
El vídeo mostrado pertenece al canal reaccionaexplota, de la Cátedra de Cultura Científica y Comunicación Digital (Universitat de Girona). En este canal encontraréis gran cantidad de vídeos muy interesantes y divulgativos que seguiremos compartiendo en entradas posteriores.






Información Bitacoras.com
Valora en Bitacoras.com: En una entrada anterior vimos la reacción producida entre un halógeno, el yodo, y el metal aluminio. Esta se trata de una reacción fuertemente exotérmica y muy llamativa. En esta ocasión traemos una reacción muy similar, ya q..…
Bitacoras.com, 10 Años Antes
Una duda: dices «Energía libre de Gibbs positiva» refiriéndote a la espontaneidad de la reacción. ¿No sería negativa para que tenga lugar dicha espontaneidad?
Alfonso, 10 Años Antes
¡Hola Alfonso! Disculpa el lapsus, tienes toda la razón, lo que es positivo es el potencial de la reacción, ahora mismo lo cambio. Un saludo y gracias por comentarlo.
QuimiTube, 10 Años Antes
[…] En una entrada anterior vimos la reacción producida entre un halógeno, el yodo, y el metal aluminio. Esta se trata de una reacción fuertemente exotérmica y muy llamativa. En esta ocasión traemos una reacción muy similar, ya que se trata de la reacción entre otro halógeno, el bromo, y el aluminio. […]
Reacción entre el bromo y el aluminio | ..., 10 Años Antes