Química de las aleaciones metálicas
Escrito por Quimitube el 18 julio
Una aleación es una mezcla de metales que se prepara mezclando los componentes fundidos y enfriando la mezcla. Las aleaciones se consideran disoluciones solidas homogéneas (iguales a lo largo de todo el sólido), en las que los átomos de un metal se distribuyen al azar entre los átomos del otro metal, o pueden ser compuestos con una composición y estructura interna muy definidas. Cuando hablamos de disoluciones sólidas, hallamos dos tipos: las interesticiales (en las que unos átomos se introducen en los intersticios o huecos de la red que forman los otros átomos) y las de sustitución (en las que unos átomos directamente han sustituido a los otros átomos en ciertas posiciones de la red). A continuación detallaremos estos dos tipos en mayor profundidad.
Las disoluciones sólidas de sustitución son disoluciones sólidas en las que los átomos del metal soluto ocupan algunas de las posiciones del metal disolvente. Las disoluciones sólidas intersticiales son disoluciones sólidas en las que los átomos del soluto ocupan los lugares vacíos (intersticios) que hay entre los átomos del disolvente. Sin embargo, esta distinción no es particularmente fundamental, porque los átomos intersticiales se sitúan, con frecuencia, en un retículo definido y, por ello, se pueden considerar como una versión de sustitución de otra red distinta. Un criterio mejor es considerar que una disolución sólida es una nueva estructura, y que su relación con la red original puede ser, en gran parte, fortuita.
Ejemplos clásicos de aleaciones son el latón (hasta un 40% de cinc en cobre), el bronce (un metal distinto del cinc o del níquel en cobre; por ejemplo, el bronce de fundición tiene un 10% de estaño y 5% de plomo) y el acero inoxidable (por encima del 12% de cromo en hierro).
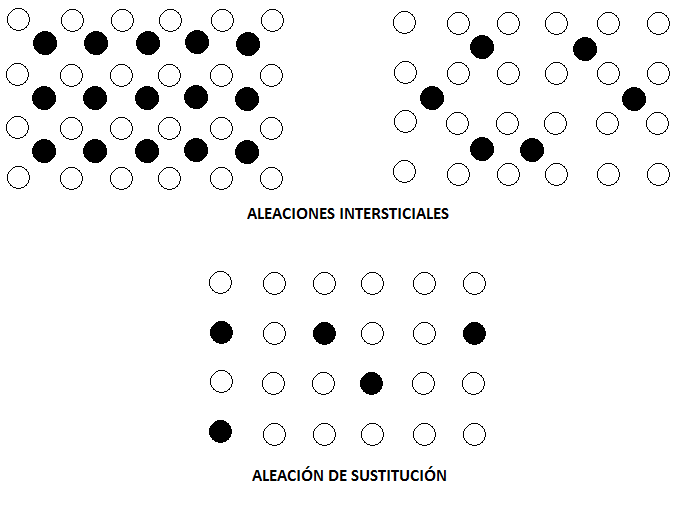
Para que se forme una aleación de sustitución, en general, se han de cumplir 3 condiciones:
– Los radios atómicos de los elementos no se deben diferenciar en más de un 15%.
– Las estructuras cristalinas de los dos metales puros son las mismas, pues ello es señal de que las fuerzas direccionales entre las dos clases de átomos son compatibles.
– El carácter electropositivo de los dos componentes debe ser semejante, pues, de otro modo, sería más probable la formación de un compuesto que de una aleación de sustitución.
Así, aunque el sodio y el potasio son químicamente semejantes, el radio atómico del sodio (1,91A) es un 19% menor que el del potasio (2,35A), por lo que los dos metales no forman una disolución sólida. Por otra parte, el cobre y el níquel, dos vecinos de la parte final del bloque d, tienen un carácter electropositivo semejante, estructuras cristalinas semejantes (ambos son ccc, que veremos con detenimiento en otra entrada lo que significa) y radios atómicos también semejantes (Ni 1,25A, Cu 1,28A, es decir, sólo un 2,3% de diferencia); por consiguiente, forman una serie continua de disoluciones sólidas, variando desde el níquel puro hasta el cobre puro. El cinc, otro vecino del cobre en el período 4, tiene un radio atómico semejante (1,37A, 7% mayor), pero no es ccc, sino ehc. En este caso, el cinc y el cobre son parcialmente miscibles y forman disoluciones sólidas solamente en un rango de composición limitado.





no me sirvio jiji, pero gracias igual xD
ayek-pa, 11 Años Antes
Bueno, hubiese preferido que te sirviera pero gracias por tu sinceridad 🙂
QuimiTube, 11 Años Antes