¿Puede el agua destilada ser corrosiva?
Escrito por Quimitube el 17 abril
Es posible que la pregunta con la que he titulado esta entrada del blog os resulte un tanto extraña. ¿Agua destilada? ¿Corrosiva? ¡Pero si solo es agua! El agua pura, H2O, como sabemos, no tiene importantes propiedades ácido-base (recordemos que el agua pura debería tener, a 25ºC, un pH de 7, con una concentración de H3O+ y de OH– equilibrada, de 10-7 M para cada uno de ellos, lo cual no es una concentración elevada). En el vídeo que os enlazo podéis consultar la teoría sobre el producto iónico del agua.
Tampoco tiene propiedades de oxidación reducción destacables, por lo que tampoco tendrá tendencia a arrancar electrones a otras sustancias, comportándose como un oxidante, o a cederlos, comportándose como un reductor.
Así pues, ¿es absurda mi pregunta inicial? Y, si no es tan absurda, ¿en qué sentido puede ser corrosiva un agua destilada?
Pues bien, podríamos decir que el agua destilada es corrosiva para determinados materiales porque, al ser tan pura, tiene una avidez muy grande por disolver otras sustancias. De hecho, no hace falta que el agua sea pura, sino que basta que se trate de un agua de muy baja dureza para que exhiba esta capacidad. Eso sí, que tenga ciertas propiedades corrosivas no significa que vaya por ahí disolviéndolo todo, ¿eh? Que quede claro que se trata de un efecto leve y que puede haber aguas con un efecto corrosivo más importante a causa no de la ausencia de solutos sino, precisamente, por la presencia de determinados solutos y sus efectos sobre los materiales, como veremos en el caso de las aguas de riego.
Agresividad de las aguas de consumo humano
Dependiendo de vuestra ubicación y de sus circunstancias (hídricas y geográficas), es posible que parte, o incluso la totalidad, del agua de suministro que salga por vuestros grifos proceda de una planta de desalación. Aquí, en las Islas Baleares, es frecuente el uso de un porcentaje de aguas desaladas. La mayor parte (si no todas) las plantas de desalación que operan en nuestro país son de ósmosis inversa. Si conocéis la técnica, sabréis que las membranas de ósmosis inversa tienen un tamaño de poro muy pequeño y retienen gran cantidad de iones, incluso monovalentes, por lo que producen un agua con muy baja salinidad, es decir, un agua con muy pocos solutos.
Pues bien, como ejemplo ilustrativo de lo que os comentaba previamente, que un agua excesivamente blanda puede presentar inconvenientes, tomaremos el Real Decreto 140/2003. Se trata de la normativa que incluye los criterios sanitarios que deben cumplir las aguas de consumo humano (agua del grifo) en nuestro país. Este Real Decreto establece que el índice de Langelier del agua debe estar comprendido entre -0,5 y +0,5. El índice de Langelier es un índice que indica si un agua tiene carácter incrustante (muchos solutos con capacidad para precipitar, como el carbonato de calcio) o corrosivo (baja dureza). En versiones anteriores de la norma, únicamente era obligatoria su determinación si toda o una parte del agua procedía de ósmosis inversa. En la versión consolidada actual (última modificación de agosto de 2018) no se establece esta premisa, sino simplemente el intervalo de valores aceptable. Pero, como veis, el agua muy blanda, como la procedente de ósmosis inversa o el agua destilada, puede dar lugar a problemas de corrosión.
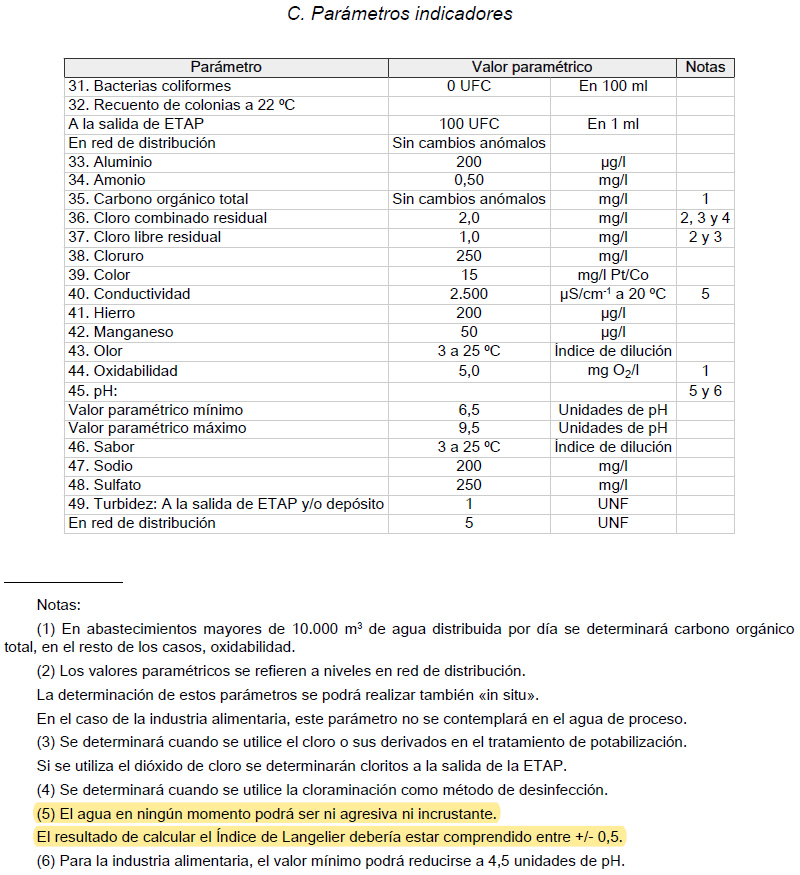
Índice de Langelier Real Decreto 140/2003
El cálculo del índice de Langelier tiene que ver con los diversos equilibrios en el agua del dióxido de carbono, bicarbonatos-carbonatos, el pH, la temperatura, la concentración de calcio y la salinidad total. Es importante para poder controlar la incrustación o la corrosión en las redes de distribución del agua y para las instalaciones interiores domésticas.
El valor ideal de este índice es 0, indicando los valores positivos que el agua es incrustante, y los valores negativos que el agua es corrosiva.
Corrosión y agresividad en las aguas de riego
Otro campo en el que es importante el carácter corrosivo o incrustante de las aguas es en agricultura. Las aguas de riego pueden causar problemas en los sistemas de riego y otros materiales con los que entren en contacto. Así, pueden causar problemas de incrustación, dando lugar a obturaciones y precipitaciones en los sistemas de riego o, en el extremo contrario, ataques químicos sobre distintos materiales, especialmente el hormigón o los metales. El proceso por el que un agua de riego es agresiva es complejo y, de hecho, hay diversos mecanismos.
Según la FAO, la mayoría de los problemas de corrosión de las aguas de riego están asociados con las aguas subterráneas. El agua subterránea varía significativamente en composición de un área a otra, pero la mayoría de los tipos son al menos ligeramente corrosivos para el hierro y algunos lo atacan severamente e incluso afectarán a metales más resistentes. La velocidad a la que se produce la corrosión depende de una variedad de reacciones de equilibrio químico, así como de ciertos factores físicos tales como la temperatura y la presión. La mayoría de los problemas de corrosión se asocian con agua de baja salinidad, aunque también a la presencia de ciertos iones específicos.
Además de la corrosión del metal por procesos electrolíticos, las aguas de riego pueden atacar también con frecuencia los elementos de hormigón. Esta corrosión puede afectar la vida de un revestimiento del canal de riego, si bien la corrosión más frecuente ocurre cuando el agua subterránea es bombeada a través de una tubería cerrada de hormigón.
La FAO establece tres tipos de corrosión que afectan a canales de riego y tuberías de hormigón:
- Corrosión por lixiviación (tipo I): ocurre cuando se disuelve cal en agua de baja salinidad o con agua que contiene dióxido de carbono libre. Puede ser un daño pronunciado en hormigón poroso de baja calidad, siendo el proceso rápido en materiales de unión. Para este tipo de corrosión es aconsejable medir el índice de Langelier, que se comentará en el apartado de análisis. Éste sería el caso de las aguas muy blandas que hemos comentado previamente.
- Corrosión por intercambio iónico (tipo II): se producen intercambios de bases entre los compuestos fácilmente solubles en el cemento endurecido y los cationes alcalinos (Ca2+, Mg2+, K+, NH4+) en el agua. Los productos de intercambio lixivian o permanecen en su lugar en el homigón como componentes no vinculantes. De este modo se pueden descomponer los silicatos de calcio.
- Corrosión por expansión (tipo III): se produce cuando las reacciones químicas causadas por el agua de riego dan lugar a productos que ocupan un volumen mayor que los componentes originales del cemento, provocando un estrés que finalmente destruye el hormigón por hinchamiento. Los sulfatos son la principal causa de este tipo de corrosión, pues tienden a combinarse con compuestos de calcio y aluminio en el hormigón formando aluminato sulfato de calcio y yesos, lo que hace que el hormigón se hinche. Los sulfatos más agresivos son el MgSO4 y el NH4SO4, pues pueden descomponer los silicatos mediante un mecanismo de tipo II. La acción del sulfato de amonio puede aumentar en presencia de nitrato, siendo todos estos iones habituales en aguas de riego, especialmente a causa del abonado.
Al igual que con los metales, los procesos de corrosión del hormigón son complejos, por lo tanto, ninguna prueba o índice único es un indicador infalible. No obstante, los criterios más utilizados son los valores límite de Biczok de 1972, aunque no tienen en cuenta la resistencia del propio hormigón a la corrosión (calidad). Los criterios de Biczok suelen aplicarse igualmente para determinar la agresividad del agua frente al suelo y del suelo sobre los elementos de hormigón con los que entra en contacto. Otros criterios existentes son los de Taylor (1977) y los de Perkins (1981).
En estos criterios diversos se basa la FAO para establecer la siguiente clasificación de las aguas de riego en función de su capacidad de corrosión del hormigón:
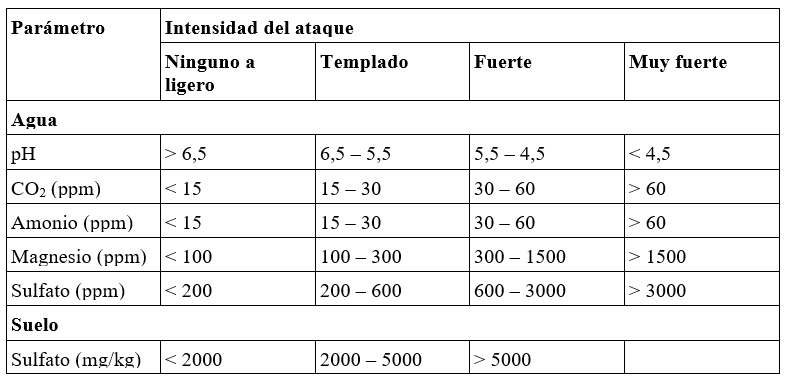
FAO: clasificación de las aguas de riego según su agresividad




