Producción industrial de amoniaco: el Principio de Le Chatelier en acción
Escrito por Quimitube el 14 octubre
En el año 1918, el químico alemán Fritz Haber (1868-1934) obtuvo el Premio Nobel de Química por sus investigaciones sobre la termodinámica de las reacciones gaseosas; estas investigaciones derivaron, en 1913, en el proceso de producción de amoniaco a escala industrial, que aún hoy se utiliza, y que lleva su nombre: proceso Haber. Aunque existen modificaciones posteriores de este método, lo cierto es que todos están basados en el proceso Haber.
El proceso permite comprender los factores cinéticos y termodinámicos que influyen en las velocidades de reacción y en la evolución de los equilibrios químicos. Esto y la abundancia del uso del amoniaco en la vida cotidiana y en otros muchos procesos, hacen que el proceso Haber combine muy bien la teoría con la utilidad práctica de la química.
Puesto que el amoniaco es un compuesto muy utilizado como materia prima para la elaboración de tintes, plásticos, fertilizantes, fibras sintéticas y explosivos, durante la I Guerra Mundial se produjeron en los Estados Unidos grandes cantidades de amoniaco por el método de la cianamida. Cuando el carburo cálcico se calienta a 1100ºC en presencia de nitrógeno, se forma cianamida cálcica, CaCN2, que, tratada al vapor, desprende amoniaco. No obstante, la cianamida es un compuesto altamente tóxico, por lo que el procedimiento cayó en desuso y en la actualidad sólo se utiliza a nivel industrial el proceso Haber.
En el proceso Haber se obtiene nitrógeno gaseoso, N2, por licuefacción parcial del aire o haciéndolo pasar a través de coque al rojo. El nitrógeno así obtenido se mezcla con hidrógeno puro, conduciendo la mezcla a lo largo de unos tubos convertidores rellenos de una masa catalítica porosa, que generalmente está compuesta por óxidos de hierro y pequeñas cantidades de óxidos de potasio y aluminio.
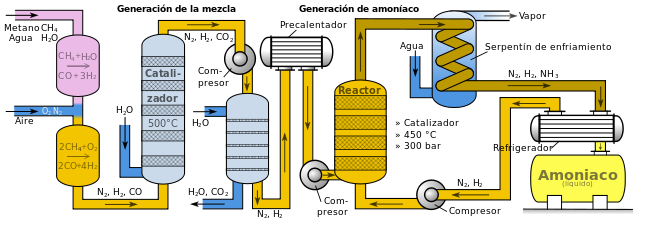
Diagrama del proceso Haber para la producción de amoníaco. Fuente: Wikipedia. Licencia CC
La reacción química del proceso a partir del hidrógeno y el nitrógeno gaseosos es exotérmica y reversible:
N2(g) + 3H2(g) ⇔ 2NH3(g) variación de entalpía negativa
Su Kc a 25ºC vale 3,6·108, este alto valor de la constante de equilibrio indica que, en el equilibrio, prácticamente todo el N2 y H2 se han convertido en NH3. Sin embargo, la reacción es tan lenta a 25ºC que no se producen cantidades detectables de NH3 en tiempos razonables. Por ello se suele operar a presiones entre 200 y 700 atmósferas y alrededor de 500ºC. El valor tan grande de Kc nos indica que, termodinámicamente, la reacción se produce hacia la derecha prácticamente en su totalidad, pero no indica nada sobre la velocidad a la que se desarrollará el proceso. Recordemos que una reacción química puede ser termodinámicamente muy favorable y, sin embargo, ser sumamente lenta.
EFECTO DE LA TEMPERATURA EN LA FORMACIÓN DE AMONIACO
Puesto que la reacción es exotérmica, según el Principio de Le Chatelier, la formación de amoniaco se verá favorecida por una disminución de la temperatura. Sin embargo, la velocidad de una reacción química aumenta con la temperatura, en cualquiera de los dos sentidos; es decir, el factor cinético se favorece a elevadas temperaturas. A medida que la temperatura disminuye, la velocidad de la reacción se hace cada vez menor y, en consecuencia, la obtención del amoníaco no tendría interés en la práctica, ya que se tardaría mucho tiempo para conseguir una pequeña concentración de NH3.
Por tanto, aquí se presenta un dilema: si se aumenta la temperatura, se aumenta la velocidad de la reacción, pero entonces dentro del reactor hay mucho N2 y H2 y poco NH3. Si se disminuye la temperatura, la reacción es lentísima. En la práctica, para resolver esta dificultad, se trabaja a una temperatura de 500-600ºC y se añade un catalizador (de platino, tungsteno u óxidos de hierro), para aumentar así la velocidad de la reacción química.
EFECTO DE LA PRESIÓN Y LOS CATALIZADORES EN LA PRODUCCIÓN DE AMONIACO
Sin embargo, incluso con ayuda de un catalizador, no podría aprovecharse industrialmente la reacción si no interviniese otro factor: la presión.
Según el Principio de Le Châtelier, un aumento de la presión favorecerá el desplazamiento de la reacción hacia la derecha, ya que a la izquierda hay 4 moles de gas y a la derecha únicamente 2 (recordemos que el aumento de la presión favorece el sentido de reacción en el que hay menos moles gaseosos). Por tanto, al aumentar la presión se favorece la formación de NH3, que es lo deseado. Ésa es la causa de que en el proceso de Haber se empleen presiones tan elevadas.
En concreto se emplean presiones que van desde las 200 atmósferas a las 1000 atmósferas. La utilización de presiones superiores está limitada por el coste que representa utilizar recipientes que resistan presiones tan elevadas.
Finalmente, la adición del catalizador de hierro finamente dividido, o también tungsteno o platino, disminuye la energía de activación del proceso y, por tanto, acelera la reacción, tanto la directa como la inversa.
RENDIMIENTO FINAL DE OBTENCIÓN EN FUNCIÓN DE TEMPERATURA Y PRESIÓN
Como el amoniaco obtenido lo vamos a ir eliminando a la vez que se va formando, la reacción química siempre evolucionará hacia la derecha, porque estamos eliminando la situación de equilibrio; el sistema siempre tenderá al equilibrio, por lo que continuará produciendo amoniaco para alcanzarlo de nuevo. Este hecho permite obtener NH3 a mayor velocidad y a temperaturas más bajas (pensemos que cuanto más alta sea la temperatura requerida en el proceso, mayor será el coste industrial del mismo).
A 500-600ºC y unas 900 atm, la conversión de N2 y H2 en amoniaco llega prácticamente a un 40%; pero sin catalizador se requerirían meses para conseguir el estado de equilibrio. Al añadir el catalizador, se consigue el mismo equilibrio en una fracción de segundo.
A las presiones empleadas, el amoniaco se separa como líquido de la mezcla gaseosa por enfriamiento, mientras el nitrógeno y el hidrógeno, no condensables, que no han reaccionado, vuelven nuevamente a los convertidores.
En la tabla siguiente se muestra el rendimiento de obtención de amoniaco en función de la temperatura y la presión:
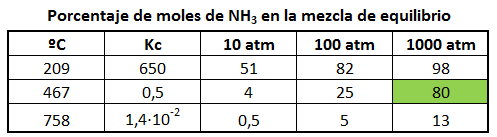
En esta tabla se observa que al aumentar la temperatura a 758ºC, la constante de equilibrio disminuye del orden de 1010 veces, lo que nos indica que la reacción se desplaza hacia la izquierda a temperaturas muy altas. Si bajásemos mucho la temperatura, nos encontraríamos con que termodinámicamente es más favorable el proceso, pero tan lento, que no es rentable industrialmente ni siquiera en presencia de catalizador. Por todo lo anterior se observa que el proceso debe efectuarse alrededor de 500ºC y a la mayor presión posible.
Entradas relacionadas:
Fabricación de ácido sulfúrico (I): método de las cámaras de plomo
Fabricación de ácido sulfúrico (II): método de contacto
Procesos industriales: producción de ácido nítrico por el método de Ostwald





La pena que inaugurara la guerra química… 😛
Ununcuadio, 12 Años Antes
[…] "CRITEO-300×250", 300, 250); 1 meneos Producción industrial de amoniaco: el Principio de Le Chatelier en acción http://www.quimitube.com/produccion-industrial-amoniaco-sintesis… por equisdx hace […]
Producción industrial de amoniaco: el Principio de Le Chatelier en acción, 12 Años Antes
Información Bitacoras.com…
Valora en Bitacoras.com: En el año 1918, el químico alemán Fritz Haber (1868-1934) obtuvo el Premio Nobel de Química por sus investigaciones sobre la termodinámica de las reacciones gaseosas; estas investigaciones derivaron, en 1913, en el proceso de…..
Bitacoras.com, 12 Años Antes
[…] Producción industrial de amoniaco: el Principio de Le Chatelier en acción http://www.quimitube.com/produccion-industrial-amoniaco-sintesis… por leguis hace nada […]
Producción industrial de amoniaco: el Principio de Le Chatelier en acción, 11 Años Antes
[…] industrial de amoniaco: el Principio de Le Chatelier | Quimitube http://www.quimitube.com Rafael Barzanallana 1 minute ago Principio de Le Chatelier, amoniaco, química, […]
Química | Annotary, 11 Años Antes
[…] En el año 1918, el químico F. Haber obtuvo el Premio Nobel de Química; sus investigaciones derivaron, en 1913, en el proceso Haber de producción de amoniaco. […]
Producción industrial de amoniaco: el Pr..., 11 Años Antes
[…] En el año 1918, el químico F. Haber obtuvo el Premio Nobel de Química; sus investigaciones derivaron, en 1913, en el proceso Haber de producción de amoniaco. […]
Producción industrial de amoníaco..., 11 Años Antes
[…] Producción industrial de amoníaco: el principio de Le Chatelier en acción […]
Producción de ácido sulfúrico por el método de contacto | Quimitube, 10 Años Antes
[…] Producción industrial de amoníaco: el principio de Le Chatelier en acción […]
Fabricación industrial de ácido nítrico - Método de Ostwald | Quimitube, 10 Años Antes
[…] En el año 1918, el químico F. Haber obtuvo el Premio Nobel de Química; sus investigaciones derivaron, en 1913, en el proceso Haber de producción de amoniaco. […]
Producción industrial de amoníaco..., 10 Años Antes