Fabricación de ácido sulfúrico (I): método de las cámaras
Escrito por Quimitube el 28 mayo
Se podría decir que el ácido sulfúrico es uno de los compuestos químicos más «antiguos», al menos en su relación histórica con el ser humano. Ya los alquimistas lo usaban, si bien lo llamaban con nombres muy curiosos: vitriolo, aceite de vitriolo y licor de azufre (este último ya se acercaba un poco más a la realidad).
Además de su antigüedad histórica, hoy en día, el ácido sulfúrico, H2SO4, es uno de los productos químicos más utilizados, y por ello es producido industrialmente en ingentes cantidades. Incluso se ha llegado a utilizar el parámetro de producción anual de ácido sulfúrico de un país como una medida de su grado de desarrollo. En la actualidad sigue teniendo la misma importancia como materia prima, aunque no la misma importancia a nivel estratégico.
Existen, esencialmente, dos métodos para la producción de ácido sulfúrico. El primero, y más antiguo, es el llamado método de las cámaras de plomo. El segundo, el método más utilizado en la actualidad, recibe el nombre de método de contacto.
En esta primera entrada hablaremos del método de las cámaras y dejaremos el método de contacto para una entrada posterior.
MÉTODO DE LAS CÁMARAS DE PLOMO PARA LA PRODUCCIÓN DE H2SO4
Este método es menos utilizado que el de contacto, ya que sólo es capaz de producir un ácido sulfúrico con una concentración de entre el 62 y el 78%.
Aquí vemos un esquema general y, después, se describirá el proceso paso a paso, si bien se trata de un proceso de producción continuo (todos los elementos del sistema están en funcionamiento simultáneamente y de forma constante, con un aporte continuo de reactivos):
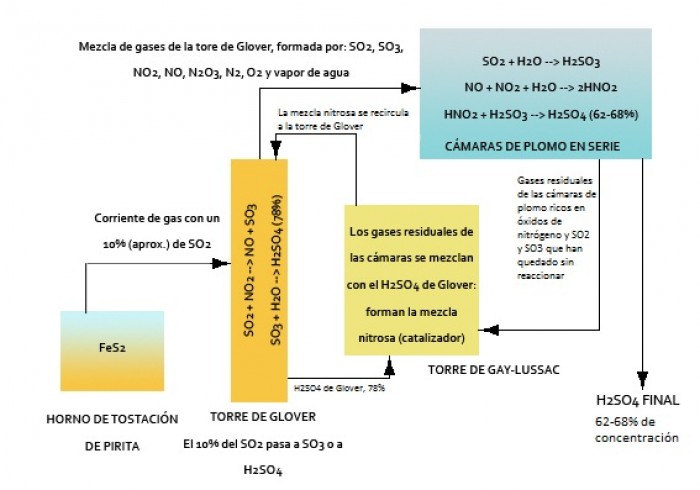
Las etapas principales de que consta la fabricación del ácido sulfúrico por el método de las cámaras de plomo son:
1. Obtención del dióxido de azufre, SO2, generalmente a partir de la principal materia prima: el mineral conocido como pirita, de fórmula FeS2. Este proceso se lleva a cabo en un horno de tostación de pirita. La tostación de la pirita produce un gas que contiene el SO2 requerido en una proporción aproximada del 10%; el 90% restante son otros gases.
2. Oxidación de SO2 producido a trióxido de azufre, SO3, por la acción del aire en presencia de un catalizador. El gas procedente del horno de tostación de pirita, con un 10% de SO2, pasa a un segundo elemento del sistema, la llamada Torre de Glover. Esta torre, de unos 16 metros de altura, está rellena con anillos de porcelana. Por la parte superior de la torre entra una corriente de la llamada mezcla nitrosa. Dicha mezcla contiene ácido sulfúrico y óxidos de nitrógeno, NO y NO2, principalmente, que son los que actúan como catalizadores.
En esta Torre de Glover, tiene lugar, en parte, la reacción:
SO2 + O2 –> SO3
El SO2 que se oxida es el que está presente en la mezcla de gases procedente del horno de tostación de pirita.
Asimismo, también cierta cantidad del SO3 que se va produciendo (en torno al 10% del SO2 inicial) pasa a ácido sulfúrico según:
SO3 + H2O –> H2SO4
En realidad, la reacción es más compleja y parece ser que también hay intervención aquí, en la torre de Glover (no solo en las cámaras de plomo posteriores) del óxido de nitrógeno:
SO2 + NO2 –> NO + SO3
SO3 + H2O –> H2SO4
Éste es el llamado ácido de torre o ácido de Glover, que tiene aproximadamente una concentración del 78%, pero no es el producto final. El ácido considerado producto final es el que se produce en las cámaras de plomo en la siguiente etapa.
En este proceso de producción de sulfúrico en la torre de Glover, los óxidos de nitrógeno son liberados sin consumir (son catalizadores, no se consumen en el proceso) y quedan en disposición de seguir siendo utilizados. Estos óxidos de nitrógeno, junto con otros gases, reciben el nombre de mezcla de gases de la torre de Glover. Dicha corriente sale de la torre de Glover y es dirigida a las cámaras de plomo. La mezcla de gases de la torre de Glover está formada esencialmente por: SO2, SO3, NO2, NO, N2O3, N2, O2 y vapor de agua.
3. Combinación del trióxido de azufre con el agua para formar el ácido sulfúrico de cámara, H2SO4. Aunque ya hemos comentado que cerca del 10% del SO2 inicial se transforma en sulfúrico en la torre de Glover, el 90% restante lo hace en las cámaras de plomo. A estas cámaras (que suelen ser de 12 metros de ancho, 18 de alto y de 30 a 60 de largo) llega la mezcla de gases de la Torre de Glover formada, como dijimos, por: SO2, SO3, NO2, NO, N2O3, N2, O2 y vapor de agua. Suelen ser de 3 a 6 cámaras colocadas en serie. Las cámaras desempeñan una triple función: suministran el espacio necesario para que se mezclen los gases convenientemente y se puedan llevar a cabo las diversas reacciones de producción del ácido, eliminar el calor producido en dichas reacciones (porque, al tener una gran superficie por su gran tamaño, facilitan la disipación del calor) y proveer una superficie de condensación para el ácido que se va formando (como en el caso del calor, a mayor superficie más eficaz será la condensación).
El mecanismo de reacción postulado para la producción de sulfúrico en las cámaras de plomo es un proceso complejo que se puede resumir del modo siguiente:
2SO2 + N2O3 + O2 + H2O –> 2SO2(OH)(ONO) (ácido nitrosilsulfúrico)
Este compuesto, en forma de niebla, se disocia al enfriarse, regenerando el catalizador N2O3:
2SO2(OH)(ONO) + H2O –> 2H2SO4 + N2O3
Otro mecanismo más sencillo propuesto para la reacción de formación del H2SO4 en las cámaras es el siguiente:
SO2 + H2O –> H2SO3
NO + NO2 + H2O –> 2HNO2
HNO2 + H2SO3 –> H2SO4
El ácido sulfúrico que condensa en las paredes de las cámaras se acumula en el fondo de las mismas y se extrae. Éste es nuestro producto final, y tiene una concentración en torno al 62 – 68%. No obstante, en el interior de las cámaras de plomo quedan gases residuales. Dichos gases residuales, compuestos principalmente por nitrógeno, oxígeno y trióxido de nitrógeno, N2O3, pasan a un nuevo elemento del sistema posterior a las cámaras: la torre de Gay-Lussac. También puede haber en dichos gases SO2 y SO3 que han quedado sin reaccionar.
4. Regeneración de la mezcla nitrosa en la torre de Gay-Lussac. Cuando los gases residuales de las cámaras entran en la torre de Gay-Lussac, se mezclan con el ácido sulfúrico de la torre de Glover. Recordemos que en la torre de Glover se produce cierta cantidad de H2SO4, en torno al 10% del SO2 inicial, y que tiene una concentración del 78% aproximadamente. Cuando en la torre de Gay-Lussac se mezcla la corriente de gases residuales procedente de las cámaras con el sulfúrico, se regenera la llamada mezcla nitrosa, necesaria par la catálisis de la reacción de producción de sulfúrico. Así, esta mezcla nitrosa producida se recircula (se retorna nuevamente) a la torre de Glover, haciendo que se trate de un proceso cerrado y continuo.
Además, si queda SO2 o SO3 en el gas residual que sale de las cámaras, como es mezclado en la torre de Gay-Lussac y recirculado de nuevo al principio del proceso, no se malgasta, sino que vuelve a entrar en el ciclo de producción.
Si durante el proceso existen fugas o pérdidas de gases que hagan que se vayan perdiendo óxidos de nitrógeno, es decir, que se vaya perdiendo catalizador, se compensa con la adición de ácido nítrico en la torre de Glover.
Entradas relacionadas:
Producción de ácido sulfúrico por el método de contacto
Procesos industriales: producción de ácido nítrico por el método de Ostwald
Producción industrial de amoníaco: el principio de Le Chatelier en acción





Se pueden ver fotos de las fabricas de produccion de acido sulfurico por el metodo de las camaras de plomo?
Juan Sanmarti, 12 Años Antes
Hola Juan, bienvenido. Lo siento, no disponemos de ninguna fotografía de las fábricas, quizá puedas encontrar algunas por la red. Un saludo.
Quimitube, 12 Años Antes
interesado como se construye la torre de galy y flower y que segurid da esta en el proceso para mejorar su pureza, gracias por su presentacion
ismael gamarra, 7 Años Antes