La oxidación del hierro
Escrito por Quimitube el 13 abril
Como sabrás, algunos metales sufren una reacción de oxidación expuestos a la intemperie y forman óxidos, es decir, sufren un proceso de corrosión. El caso más conocido por su impacto económico y por ser el más visual, es el del hierro en su última fase: la formación de herrumbre, óxido férrico, Fe2O3. Aproximadamente un 5% de la producción de hierro se emplea en reponer el que se ha oxidado. Es decir, de cada 1000 millones, ¡50! ¡Ahí es nada!
Sin duda, recordarás el característico color rojizo de este compuesto:
A éste ya le va tocando un cambio. ¡A gastar!
Otros metales, en cambio, sufren este proceso mucho más lentamente (como ocurre con el cobre, sobre el que se forma una pátina verdosa, o la plata) o, simplemente, no se corroen y permanecen siempre brillantes, como ocurre con dos metales preciosos: el oro y el platino (esta capacidad de brillar «indefinidamente» y de no corrosión es una de las cualidades que los encarecen).
¿Cuál es el motivo por el cual el hierro se corroe fácilmente y otros metales no? ¿De qué depende? Pues depende, como hemos visto ampliamente en la teoría de oxidación reducción y en los ejercicios, de sus potenciales estándar de reducción.
El potencial estándar de reducción del par Fe(2+)/Fe es bajo, -0,44V, lo que indica que el hierro metálico tiene tendencia a oxidarse en contacto con elementos que tengan un potencial estándar de reducción superior a este valor (puedes consultar la tabla de potenciales estándar de reducción). En cambio, el potencial estándar de reducción del par Au(3+)/Au es de 1,31V, lo que indica que el catión es prácticamente un oxidante tan potente como el dicromato potásico (1,33V) o como el cloro gaseoso (1,36V). Por ello, el oro metálico no se deja oxidar así como así. Se ha ganado a pulso la clasificación de metal precioso gracias a su estupenda configuración electrónica.
Pero el hierro metálico no tiene una configuración electrónica tan favorable que le permita mantener sus electrones en su sitio contra viento y marea, de forma que, en presencia de agua y oxígeno atmosféricos, se oxida. Lo cierto es que el proceso es bastante complejo y todavía existen lagunas, pero, a grandes rasgos, sucede en dos etapas que se detallan a continuación:
ETAPA 1:
Oxidación del hierro metálico a Fe(II), que permanece en disolución (no en una disolución propiamente dicha o como acostumbras a ver las disoluciones, sino en la interfase hierro-aire de la superficie del metal. Recordemos que interviene agua de la atmósfera y se crea una especie de película).
Lo que sucede en esta etapa es que se da un proceso análogo al de una pila galvánica. La superficie del hierro funciona como ánodo (recuerda que en el ánodo tiene lugar la oxidación) y el Fe metálico pasa a Fe(II), según la semirreacción:
Fe –> Fe2+ + 2e
Una región contigua de la superficie del metal funciona como cátodo (recuerda que en el cátodo siempre tiene lugar la reducción), y en él se produce la reducción del oxígeno atmosférico a agua, según la semirreacción:
1/2 O2 (g) + 2H+(ac) + 2e –> H2O (l)
La reacción global es:
Fe(s) + 1/2 O2 (g) +2H+(ac) –>Fe2+(ac) + H2O (l)
Probablemente te preguntes de dónde salen los protones que intervienen en la semirreacción de reducción del oxígeno atmosférico a agua si, en principio, no tenemos ningún ácido. Estos protones proceden de diversos ácidos que encontramos en el ambiente, por ejemplo el ácido carbónico, H2CO3 (¡el de los refrescos con gas!) que se produce por reacción entre el dióxido de carbono atmosférico, CO2, y el agua; o bien por el ácido sulfúrico presente en la atmósfera debido a la lluvia ácida (reacción del trióxido de azufre, SO3, con agua, para dar H2SO4) en zonas contaminas con óxidos de azufre.
El potencial de esta pila galvánica se puede calcular con los potenciales estándar de reducción de cada una de las dos semirreacciones:
Eo = Eo(cátodo) – Eo(ánodo) = 1,23 – (-0,44) = 1,67V
Un valor positivo considerablemente alto (recuerda que un valor positivo de potencial estándar en una pila implica una variación de energía libre de Gibbs negativa, es decir, una reacción espontánea).
ETAPA 2:
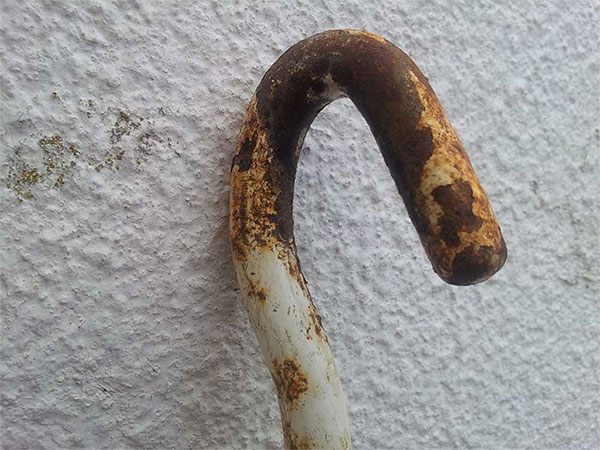
Oxidación del hierro (II) a hierro (III) y formación de óxido de hierro (III), Fe2O3 (en realidad se forma el compuesto n-hidratado, es decir, precipita con cierta cantidad no homogénea de moléculas de agua y su fórmula se representa como Fe2O3·nH2O). El óxido de hierro (III) es un compuesto insoluble y precipita en forma de herrumbre sobre la superficie del metal. Es este óxido de hierro (III) el que conocemos habitualmente como óxido (decimos que el hierro está oxidado) y tiene color rojizo o anaranjado. Aquí tienes un ejemplo, que una imagen vale más que mil reacciones:

Éste cualquier día deja en el suelo a alguien. ¿Quién iba a decir que un día fue una tuerca reluciente? ¡Quién la ha visto y quién la ve!
Por tanto, en la segunda etapa el proceso de oxidación continúa según la ecuación:
2Fe2+(ac) + 1/2O2 (g) + 2H2O –> Fe2O3 (s) + 4H+(ac)
A parte de formarse la herrumbre, en esta segunda etapa se regeneran los protones consumidos en la primera, lo que hace más fácil que el proceso continúe avanzando.
El óxido de hierro (III), Fe2O3, se deposita en forma de polvo ocre sobre la superficie del hierro metálico, formando una capa porosa que no está fuertemente adherida a la superficie metálica (recuerda cómo te manchas los dedos al tocar un hierro oxidado). Por este motivo, el óxido formado no detiene el proceso de oxidación del hierro, que prosigue hasta capas más profundas. Es natural que suceda esto: el hierro es un metal refinado, es decir, ha sufrido un proceso para obtenerlo como tal. Las menas más importantes de hierro en la naturaleza son de óxido de hierro (III).
Con el tiempo, puede convertirse en herrumbre la totalidad de la pieza de hierro metálico. Naturalmente, si se trata de piezas metálicas que forman parte de estructuras, la estabilidad y la seguridad quedan comprometidas mucho antes de que la pieza se oxide por completo y hay que cambiar mucho hierro al año, con el consecuente gasto económico.
Sin embargo, como todo tiene una cara y una cruz, la corrosión del hierro no sólo causa perjuicios a la economía, aunque se dediquen muchos millones cada año a reparar los daños producidos por la corrosión. Porque otra forma de reparar la corrosión es evitarla antes de que suceda utilizando recubrimientos y productos para evitar la oxidación del hierro, que representan un volumen de negocio muy grande para las empresas de pintura.
Quizás también te interesen:
La reacción redox implicada en el funcionamiento de una pila alcalina





para mi es muy interesante toop esto del oxido pork sinceramente lo odio demasiado no se pork pero le tengo asko y me gustaria saber mas de como evitar k mis objetos personales se oxiden
paulette saac villacis, 12 Años Antes
tranqui si el oxido férreo no es dañino para la salud y no le tengas asco solo es un cambio molecular o qco… saludos..
Jo <3
hey, 11 Años Antes
[…] […]
Anónimo, 12 Años Antes
Como siempre, muy interesante!!!
Una cosa, con el agua ocurre lo mismo? Es decir, el hierro se oxida exactamente de la misma manera en presencia de agua?
Si la reacción en aire es:
Fe –> Fe(2+) + 2e
1/2 O2 (g) + 2H(+)(ac) + 2e –> H2O (l)
En agua como sería?
GRAAACIIIIASS!!! 😀
SARA, 12 Años Antes
¡Hola! Es una muy buena pregunta. En principio, si en el medio no hay otra especie capaz de oxidar al hierro, es decir, si no hay un oxidante en el agua, el oxidante seguirá siendo el oxígeno, puesto que cierta cantidad de oxígeno atmosférico se disuelve en ésta; la concentración oscila entre 7 y 12 ppm (mg/l) en función de la temperatura.
QuimiTube, 12 Años Antes
[…] El Fe2O3 se produce cuando se reacciona el Fe con el O2 (con el oxígeno atmosférico); sin embargo, viendo […]
Relato: “Cuidado con lo que arrojas al mar” | Roskiencia, 12 Años Antes
queria preguntar como se produce la oxidacion del hierro bajo tierra , cumple las mismas estapas o que diferencia hay respecto a la oxidacion al aire libre? tambien cuanto depende de la composicion del suelo en el que esta enterrado.. gracias
andres, 12 Años Antes
Hola Andrés, la verdad es que la pregunta que formulas es compleja y no conozco en profundidad las etapas que se dan, aunque imagino que deben ser semejantes dado que los suelos también presentan oxígeno y agua, a pesar de no darse el proceso al aire libre. No obstante, sí que debe tener una relación muy estrecha con la composición del suelo, dado que esta composición te variará el pH (importante en toda reacción química), así como también la disponibilidad de agua y la concentración total de oxígeno, ya que el gránulo del suelo y lo compacto o poroso que este sea te va a condicionar la presencia de gases atmosféricos en el mismo. Otro factor que debe influir es la flora bacteriana aerobia presente. En fin, como veas no te puedo dar una respuesta clara porque no conozco en profundidad el proceso, espero que encuentres información precisa. Un saludo grande.
QuimiTube, 12 Años Antes
si tengo un elemento oxidado y lo recubro con algun material, el proceso de oxidacion se detiene o continua de manera interna
juan valdes mejia, 12 Años Antes
Si el recubrimiento es completo, e impide que el material esté en contacto con oxígeno o con agua en ningún caso, debería detenerse el proceso de oxidación. Lo que ocurre es que en la práctica esto es complicado, pero creo que hay algunos recubrimientos galvánicos que permiten aplicarse directamente sobre el óxido sin tener que lijar.
QuimiTube, 12 Años Antes
HOLA QUE TAL OYE ME PUDIERAS DECIR POR FAVOR COMO ES QUE SE DA EL PROCEDO DE OXIDACION EN EL HIERRO . GRACIAS
carlos nava, 11 Años Antes
Hola Carlos, esto es lo que está explicado en la entrada con detalle, te sugiero que lo leas completo. Un saludo.
QuimiTube, 11 Años Antes
Hola, el óxido cambia su característico color rojo marrón cuando se impregna de aceite? o lo mantiene? por otro lado, en caso de tener duda si en realidad es óxido, que prueba tengo que hacer para asegurarme que sea óxido?
Francisco, 11 Años Antes
!hola! tengo una duda un poco tonta pero enfin …
si metemos un I Phone 5 en agua sumergido ¿x muy bueno q sea se estroperia? ¿x q el xperia Z se puede mojar?
anonimo, 11 Años Antes
¡Hola! Pues supongo que sí que se estropearía, no lo sé… Depende de lo estanco que sea el recipiente. Si la carcasa es lo suficientemente hermética para que no entre nada de agua podrás sumergir el teléfono o eso creo, pero lo digo por suposición.
QuimiTube, 11 Años Antes
muy bueno
faiber, 11 Años Antes
¡Gracias!
QuimiTube, 11 Años Antes
pienso que es la mejor explicacion sobre la oxidacion graxiax <3
luis daniel osorio villlegas, 11 Años Antes
¡Hola! Muchas gracias, me alegro que te haya servido.
QuimiTube, 11 Años Antes
disculpe, cual es el anio de la publicacion? si me hace el favor
luis rivera, 11 Años Antes
Hola Luis, esta entrada es del año 2012. Un saludo.
QuimiTube, 11 Años Antes
queria preguntar si los postes de hierro enterrados en la tierra son contaminantes de las napas de agua en el procerso de oxidacion? y en el aire gracias
armando, 10 Años Antes
Lo lamento Armando, no tengo conocimientos medioambientales profundos para responderte a esa pregunta, pero te sugiero que busques legislación sobre contaminación de masas de agua y suelos y que mires qué niveles hay en ppm para el hierro y otros metales pesados. Eso te podría servir. Un saludo.
QuimiTube, 10 Años Antes
Hola, en base al delta G, podría entonces confirmar que el proceso de oxidación del Hierro es un proceso espontáneo.? Es que estoy leyendo un libro (Corrosión y oxidación por West año 1986) y en capítulo 5: ¿Por qué ocurre la corrosión.? El Delta G de oxidación me da un igual a la sumatoria del potencial químico del ion hidratado más el potencial químicoe de los electrones intercambiados menos el potencial químico del metal puro menos el potencial químico del agua adsorbida todo esto menor a cero (dándome referencia a que delta G es menor a cero, espontánea) pero enseguida me habla el texto del por que los metales no se desgantan espontáneamente. Entonces estoy confundida.
Liliana, 10 Años Antes
Hola Liliana, ¿y qué te dice de la no corrosión espontánea? A lo mejor se refiere a que cuando mantenemos el metal alejado de la humedad o de la intemperie la reacción ya no es espontánea… O tal vez se refiera a que es espontánea pero es una reacción lenta…
QuimiTube, 10 Años Antes
Hola. Esta pregunta la escribo textual de mi guía de problemas: «suponga que un perfil de hierro se encuentra sumergido en el agua de un río de manera que en la superficie del agua el sistema está aireado pero en el fondo del lecho, donde apoya la estructura, hay mucho menos oxígeno. ¿donde se producirá la reaccion anodica y dónde la catodica?» Muchas gracias quimitube!
ivan bietti, 10 Años Antes
¡Hola! Fíjate en cada reacción química que hemos escrito. La anódica:
Fe –> Fe2+ + 2e
Y la catódica:
1/2 O2 (g) + 2H+(ac) + 2e –> H2O (l)
Es decir, en el cátodo se reduce el oxígeno y por tanto se llevará a cabo en aquel lugar donde haya oxígeno, si no lo hay, no será posible. Así, te diría que la parte sumergida, donde no hay oxígeno, actuará como ánodo, y la superficie, donde hay oxígeno, actuará como cátodo.
Sin embargo, no todos los libros plantean el proceso de oxidación como yo lo he planteado en esta entrada. Fíjate si en tus apuntes habéis planteado el proceso de forma distinta.
Un saludo.
QuimiTube, 10 Años Antes
Aleluya! hasta que encuentra buena información por toda la red sobre como se óxida el hierro
fernanndo, 9 Años Antes
Gracias Fernando, me alegra que te haya servido. Un saludo.
QuimiTube, 9 Años Antes
que grande! excelente justo lo que buscaba!! gracias!
claudio, 9 Años Antes
Me alegra que te sirviera, un saludo grande.
QuimiTube, 9 Años Antes
hola! estudio odontologia, y tengo que rendir corrosion dentro de la boca..
El hierro es uno de los metales que utilizamos, y suponiendo que en la boca tenemos tanto h2o como o2 , serviría esta reacción?
julieta, 9 Años Antes
Hola Julieta, desconozco la aplicación concreta a odontología, pero si utilizáis hierro puro de fórmula Fe la reacción tiene que ser similar a esta. Al fin y al cabo el hierro en la boca es un material a la intemperie y a presión normal, lo que no sé es cuáles son las condiciones de acidez en la boca, pero como te digo yo creo que las reacciones te sirven.
QuimiTube, 9 Años Antes
Hola Gracias por ayudarme en la tarea muchas gracias los quiero mucho
daniela, 9 Años Antes
¡Gracias a ti por comentar! Un saludo grande.
QuimiTube, 9 Años Antes
Gracias
fiona alcala, 9 Años Antes
hola, una consulta en un auto chocado que tiene perdida de pintura y el metal queda expuesto al clima húmedo cuanto tiempo aprox se podría oxidar el metal
MARISOL, 8 Años Antes
Hola Marisol, lo siento, no dispongo de estos datos, tendríamos que tener en cuenta tanto el metal que es como la humedad exacta, la temperatura… Pero yo no tengo estas cinéticas.
QuimiTube, 8 Años Antes
¿Tienes información de los defectos cristalinos en el óxido de hierro? buen post. Gracias.
Jonathan, 8 Años Antes
Lo siento Jonathan no tengo nada tan específico. Un saludo.
QuimiTube, 8 Años Antes
El agua es un oxido?
Abril, 4 Años Antes
En realidad sí, un óxido de hidrógeno.
QuimiTube, 4 Años Antes
Muchas gracias por el artículo, he aprendido muchos detalles que desconocía.
Antanaes, 4 Años Antes
Gracias a ti por tu comentario.
QuimiTube, 4 Años Antes
Hola, tengo una duda
Cuál es la formula para la oxidacion de los metales?
VERONICA DE LOERA GARCIA, 4 Años Antes
Hola, ¿te refieres a la reacción química ajustada?
QuimiTube, 4 Años Antes
A la formula de como se forma la oxidacion del hierro
🙂
VERONICA DE LOERA GARCIA, 4 Años Antes
Ah, pues la tienes en la propia entrada, es esta: 2Fe2+(ac) + 1/2O2 (g) + 2H2O –> Fe2O3 (s) + 4H+(ac). El óxido de hierro que se forma como ves es el Fe2O3.
QuimiTube, 4 Años Antes
Quiero saber cuál es la ecuación formada por el agua. Hierro y oxígeno porfa
Dany, 4 Años Antes
¡Hola! Todas las ecuaciones las tienes en la propia entrada. Un saludo.
QuimiTube, 4 Años Antes