¿Por qué se enseña a calcular cuántas «moléculas» de compuesto iónico hay en x moles?
Escrito por Quimitube el 13 enero
No es la primera vez que veo que en las clases, principalmente en el primer contacto con la química (tercero y cuarto de ESO), se inician los cálculos estequiométricos asociados al concepto de mol. Cuando se explica dicho concepto, el alumno suele tener poca o nula idea de enlace químico, de cómo se enlazan los átomos y de qué tipo de agrupaciones pueden formar. No sé hasta qué punto tiene sentido ver antes el concepto de mol que el tipo de sustancias y de enlaces, y me consta que así es habitualmente.
Al fin y al cabo, el mol no es más que una unidad de medida de cantidad de sustancia, ¿no deberíamos saber qué medimos antes de medirlo? ¿Tiene sentido enseñarle a un alumno que una determinada montaña, por ejemplo el Puig Major, mide 1445 metros de altura si no sabe lo que es una montaña? ¿Qué provecho le aportará ese dato? O peor aún, ¿si piensa que una montaña es un río? Llevando esta analogía a nuestro terreno, ¿de qué sirve que un alumno sepa que 1 mol de oxígeno gaseoso son 6,022·10^23 moléculas de O2 si no entiende o no diferencia el concepto de molécula?

Amadeo Avogadro, químico italiano al que debemos el Número de Avogadro, que indica la cantidad de partículas que hay en un mol de sustancia.
Así, ¿por qué se les enseña a calcular cuántas moléculas de NaCl hay en x moles de NaCl? No solo ese cálculo no le sirve de nada al alumno (con un poco de suerte lo habrá olvidado en dos o tres días) sino que además está partiendo de un concepto del todo erróneo, a menudo sustentado en un vago «no importa que no sea correcto, lo importante es que practican los cálculos estequiométricos y así los van comprendiendo». Los cálculos estequiométricos no son un fin en sí mismos. Yo formo parte de esos profesores que todo lo hacen con factores de conversión, es cierto, pero son para llegar a algo, a un resultado que nos aporte un dato sustentado en un concepto teórico (es lo de siempre, la práctica aunada con la teoría).
Es muy cómodo llamar molécula a una agrupación de un sodio y un cloro solo porque la fórmula del compuesto es NaCl y es fácil decir que 1 mol de cloruro de sodio son 6,022·10^23 moléculas de cloruro de sodio. Sí, fácil y cómodo. Pero es mentira, porque los compuestos iónicos no forman moléculas, sino redes cristalinas en las que los iones Na+ y Cl- se estructuran perfectamente. Si el alumno no sabe esto previamente, ignoro cuál es el objetivo de los cálculos.
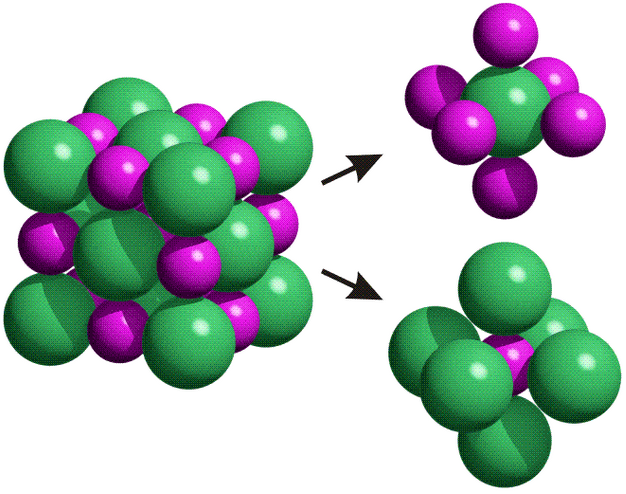
¿Y si no forman moléculas, de qué sirve que se les pueda aplicar artificialmente el cálculo a partir del concepto de mol? El alumno aprenderá a aplicar algo de forma mecánica; probablemente los que mejor lleven los cálculos matemáticos, o aquellos a los que mejor les resulte memorizar una secuencia de pasos enlazados, sacarán una muy buena nota en el examen, pero no tendrán mucha idea de química.
Soy partidaria de simplificar conceptos de cierta complejidad que no se van a utilizar en un futuro para que el máximo número de alumnos de la clase los comprenda, como algunos que se ven en segundo de bachillerato (por ejemplo, la ecuación de Schrödinger, el Principio de Incertidumbre o la Hibridación de orbitales), pero los temas de enlace químico y del mol son recurrentes y esenciales, y sobre ellos se construye gran parte del conocimiento químico que se dará a lo largo de los cursos. Son conceptos vertebradores, que diría un pedagogo. Simplificar (erróneamente) estos conceptos en sus primeras fases de aprendizaje por comodidad es un problema enorme: si no se corrige el error, el alumno acabará con un mal concepto siempre; si el error se corrige en cursos posteriores, no hará más que causarle confusión y desinterés (¿por qué antes me lo explicaron distinto?).
Así, como diría con mayor contundencia nuestro compañero @luisccqq:
¡El cloruro sódico no forma moléculas!
También te puede interesar:
El aprendizaje de fórmulas químicas en la enseñanza: ¿un fin o un medio?





[…] Con mucha frecuencia, en la primera toma de contacto con la química, se enseña erróneamente a calcular el número de moléculas presentes en un compuesto iónico. […]
Cálculo erróneo del número..., 11 Años Antes