Por qué los «cristales» no son cristales
Escrito por Quimitube el 27 noviembre
Seguro que estas frases y otras muy similares os resultan de los más habituales:
«Qué pereza, tengo que limpiar los cristales«.
«Madre mía, cómo me has dejado los cristales con esas manos de chocolate».
«Se ha empañado el cristal del coche».
«Cuidado, no vayáis descalzos, que se ha roto antes un bote de cristal«.
Yo misma lo digo de este modo, aún sabiendo que incurro en un error imperdonable desde el punto de vista químico: en todas estas expresiones, la palabra cristal está químicamente mal utilizada, porque el material transparente que usamos para fabricar espejos, ventanas, lentes, botellas… no es un cristal, es un vidrio. Entonces… ¿cuál es la diferencia existente entre ambos?
Los cristales son materiales altamente ordenados en los que cada átomo ocupa una posición precisa. Es decir, un cristal es una maravilla de la arquitectura, pero a nivel microscópico. Por ejemplo, el diamante es un sólido cristalino en el que cada átomo de carbono ocupa el centro de un tetraedro, siendo a su vez el vértice de otros tetraedros; cada carbono se une, por tanto, a otros cuatro átomos de carbono, y así en las tres dimensiones. También son cristales los sólidos iónicos, como la sal común, formada por iones sodio (Na+) y aniones cloruro (Cl–); en los cristales iónicos los aniones y los cationes ocupan una posición precisa y se rodean siempre del mismo número de iones de carga contraria; o los metales, que también tienen una estructura íntima altamente ordenada, formada por cationes en unas posiciones precisas. Esto es lo que entendemos por material cristalino en química, la cristalinidad podría definirse como el orden microscópico preciso de las partículas en un determinado material.
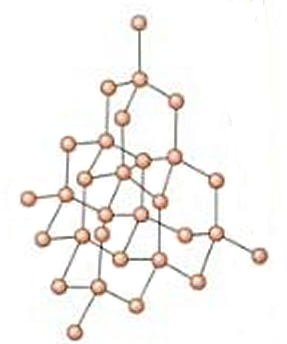
Estructura cristalina del diamante. Cada átomo de carbono se une a otros cuatro átomos de carbono formando un tetraedro, lo que se repite sucesivamente en el espacio tridimensional.
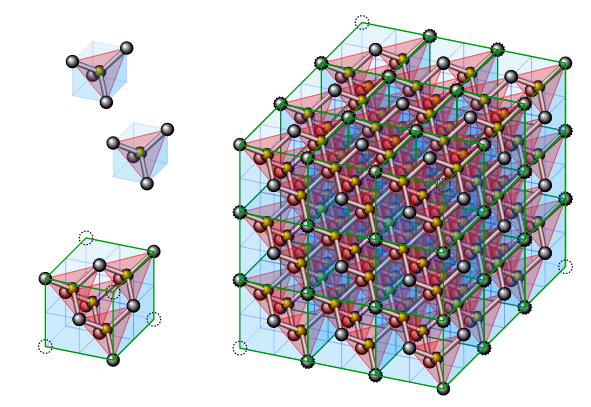
Celda cúbica isométrica del diamante.
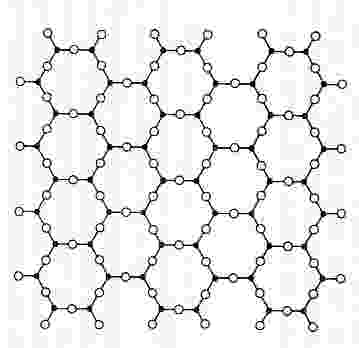
Planta de la estructura cristalina de un fragmento de cuarzo, formado por sílice, dióxido de silicio, SiO2, con estructura cristalina y, por tanto, altamente ordenada. En la sílice, cada átomo de silicio se une a cuatro átomos de oxígeno formando un tetraedro.
Si lo pensáis bien, la belleza de esto es inmensa: a nivel microscópico, aunque no podamos verlo a simple vista, existen partículas que presentan un orden perfecto, como si alguien se hubiese entretenido en colocarlas así, una a una, siempre en el mismo punto relativo para alcanzar la simetría. ¿No os parece increíble? ¿No es bello que la materia tenga una estructura perfectamente definida?
Reflexiones filosóficas a parte, los vidrios son muy distintos. Los vidrios son materiales amorfos en los que los átomos han perdido el orden y se hallan colocados de forma un tanto caótica. Ciertos enlaces se siguen manteniendo, pero ya no tenemos esa perfección del cristal. Esto es un ejemplo de la estructura del vidrio de silicato que usamos habitualmente, el de las ventanas o de los vasos (vidrio de dióxido de silicio, SiO2, junto con otros muchos aditivos, como carbonato de sodio o de calcio):
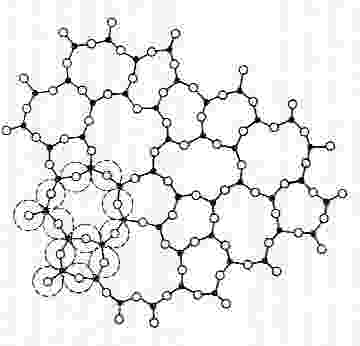
Planta de un fragmento de sílice con estructura amorfa.
En la imagen previa vemos que ya no hay una regularidad perfecta a lo largo del compuesto, los enlaces no están perfectamente ordenados. Aunque cada átomo de silicio seguirá formando un tetraedro, la disposición de los oxígenos y los enlaces que forman estos átomos con los de silicio se dispersan, la regularidad se ha perdido y, por tanto, ya no tenemos un cristal, sino un vidrio o un compuesto en estado vítreo.
Así que ya sabéis, si vuestros hijos remolonean para ordenar su habitación, podéis sugerirles que la ordenen, o también les podéis sugerir que la dejen cristalina en diez minutos.





¡Genial! Resulta que yo también estoy explicando esto a «mis terceros y segundos»…Por supuesto, habría que incidir más en lo que es «materia ordenada» estos días. De hecho…Con el advenimiento de los nuevos materiales hemos encontrado variantes divertidas:
-Policristales (mi favorito ahora, con cristalitos y granos).
-Cuasicristales (antes mis favoritos).
-Materia amorfa.
-Policuasicristales.
Y no sé si me dejo algún nuevo estado exótico de la materia pseudocristalino…
Amarashiki, 8 Años Antes
Jajaja, pobres cuasicristales que han sido desplazados de tus preferencias…
Quimitube, 8 Años Antes
Mira, un paper sobre el sexy grafeno policristalino…
https://arxiv.org/abs/1612.01727
Espero así entiendas por qué los cuasicristales, aunque molan, han caído en mi lista. Además, es muy posible que todo cuasicristal es el fondo una proyección de un (poli)cristal en dimensiones superiores…Aunque no está demasiado investigado el tema…
A veces tengo ganas locas de tener ropa hecha totalmente de grafeno o hecha de Vantablack, pero me temo sería muy cara en estos momentos, glups…
Saludos.
Amarashiki, 8 Años Antes
Excelente aporte. Muchas gracias por la informacion!.
Estructuras Metalicas, 8 Años Antes
Hola.
¿Tenéis alguna dirección de correo en la que formularos una petición?
El formulario de contacto se queda colgado al efectuar el envío.
Muchas gracias.
Jesús
Jesús, 8 Años Antes
Hola Jesús, perdona que te responda a estas alturas. Como verás en la última entrada del blog, no he retomado Quimitube hasta ahora. Puedes escribirme al e-mail quimitube@gmail.com e intentaré responderte en la medida de lo posible. Un saludo.
QuimiTube, 5 Años Antes