El NOxer: un asfalto descontaminante
Escrito por Quimitube el 25 noviembre
La ciencia de materiales es probablemente una de las ramas de la ciencia que más avances ha producido en las últimas décadas. Desde el descubrimiento, el desarrollo y las aplicaciones de los polímeros, como la fibra de carbono o el kevlar, los nuevos materiales semiconductores, como el arseniuro de galio o el nitruro de aluminio, o el grafeno (que valió un Premio Nobel de Física). Y así podríamos mencionar muchos otros ejemplos que muestran que los materiales pueden tener un impacto abrumador en nuestras vidas y también utilidades mucho descubiertas después de su síntesis. Uno de estos materiales con aplicaciones sorprendentes es el NOxer®, bloques de asfalto capaces de llevar a cabo reacciones de fotocatalíticas para reducir la contaminación en las ciudades. Se instaló en Madrid en 2008, siendo esta la primera ciudad española en utilizar este material y con aparentemente buenos resultados.

¿Imaginas que este asfalto estuviese trabajando para descontaminar la ciudad? Fuente: Flickr. Autor: Miguel Díaz. Licencia CC By-SA
Forma parte de los denominados nanomateriales activos, capaces de eliminar contaminación en las ciudades. Dentro de estos no solo hay asfalto, sino también otros muchos elementos constructivos también patentados, aunque en esta entrada vamos a centrarnos en el Noxer. En general, la fotoquímica aplicada a toda clase de materiales de construcción y obra civil es una solución muy interesante para reducir la contaminación ambiental mediante el uso de nanocompuestos fotocatalíticos. Su desarrollo permite reducir las emisiones contaminantes de los vehículos, especialmente en ambientes urbanos, donde las altas concentraciones de los compuestos contaminantes hacen que su efectividad se incremente considerablemente.
Los óxidos de nitrógeno NOx y sus consecuencias en la atmósfera (NO y NO2)
El óxido nítrico (NO) y el dióxido de nitrógeno (NO2) se suelen considerar en conjunto con la denominación de NOx; se trata de contaminantes primarios de mucha trascendencia en los problemas de contaminación. En general, los procesos industriales y los transporten emiten una mayor cantidad del monóxido de nitrógeno, NO, pero este puede oxidarse rápidamente a NO2 en la atmósfera, motivo por el cual finalmente la cantidad de NO2 presente en la misma es superior. Se trata de compuestos muy importantes a nivel de contaminación ambiental y de salud humana, ya que pueden contribuir a la lluvia ácida (por formación de ácido nitrico, HNO3) y también a la formación del esmog fotoquímico, problema considerable en las ciudades. Además, se trata de compuestos que dañan la salud de seres humanos y de plantas en concentraciones elevadas, motivo por el cual la legislación europea, en la Directiva 1999/30/CE, tranaspuesta en nuestro Real Decreto 1073/2002 [1] obliga a que el valor límite de estos óxidos, medidos como NOx, sea de 40 μg/m3 como media anual. La emisión de estos óxidos se debe principalmente a las actividades humanas, siendo el transporte responsable de más de la mitad de la misma.
¿De qué material está fabricado el NOxer?
Los bloques de NOxer® están formados por mortero de cemento que, posteriormente, se cubre con una fina capa de óxido de titanio (IV), TiO2, de entre 5 y 7 milímetros de grosor. Este óxido de titanio tiene una muy buena actividad como catalizador heterogéneo en determinadas reacciones químicas, utilizando la luz del sol para que se lleven a cabo. Por este motivo, durante el día, y especialmente en días soleados, el NOxer puede eliminar gran cantidad de los óxidos de nitrógeno NO y NO2 de la atmósfera adyacente, transformándolos en nitratos solubles (NO3–) que se eliminan posteriormente con el agua de lluvia por el alcantarillado. Se estima que en un día soleado puede llegar a eliminar hasta el 90% de los contaminantes, siempre y cuando, claro está, que la cantidad de asfalto instalada esté bien dimensionada para el problema a tratar.

Estructura microscópica del dióxido de titanio obtenida por microscopía electrónica de barrido. Fuente: Flickr. Autor: Luciana Christante. Licencia CC By-NC-ND
Estas reacciones químicas fotocatalíticas tienen gran interés, porque además de no suponer un sobrecoste inasumible, no requieren la adición de otros reactivos químicos, utilizando como “reactivo” la luz ultravioleta procedente del sol y aprovechando, además, una fuente natural e inagotable. Los semiconductores de banda ancha como el TiO2, en estas circunstancias, alcanzan un potencial oxidante extraordinario (gracias a la presencia de oxígeno atmosférico) que posibilita no solo la eliminación de óxidos de nitrógeno, sino también la oxidación de contaminantes orgánicos también presentes en la atmósfera.
El TiO2 presenta tres formas polimórficas a presión atmosférica: rutilo, brooquita y anatasa. Rutilo es la única fase termodinámicamente estable, mientras que anatasa y brooquita son metaestables y se transforman a rutilo irreversiblemente por calentamiento. Sin embargo, la estructura que presenta mayor actividad fotocatalítica es la anatasa, que es la utilizada de manera habitual para aplicaciones de descontaminación ambiental.
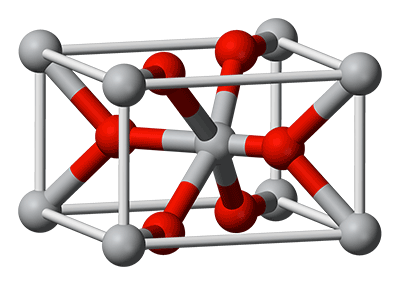
Celda unidad del rutilo. En rojo se muestran los átomos de oxígeno y en gris los de titanio.
Se trata de un compuesto altamente insoluble en agua, por lo que no hay problema con las aguas de lavado o de lluvia. Además, su toxicidad es muy baja y, de hecho, está aprobado su uso como aditivo alimentario, lo que nos muestra su elevada inocuidad. No es tóxico ni a través de la piel, ni de los ojos ni por ingestión, como decimos, y únicamente puede provocar cierta irritación de las vías respiratorias por inhalación a largo plazo, cosa que no se produce de ningún modo con este tipo de asfalto. Sí que se produce en el caso de manipulación del sólido pulverulento, en cuyo caso conviene consultar la ficha de seguridad del INSHT [2].
¿Cómo actúa al TiO2 como catalizador?
La absorción de radiación ultravioleta por parte del óxido de titanio hace que pase a un estado electrónico excitado. Esto hace que puedan tener lugar la cadena de reacciones siguientes:
Reacción de fotolisis del agua:
H2O → H+ + OH· (radical hidroxilo) + e–
Formación del anión superóxido a partir de oxígeno atmosférico:
O2 + e– → O2–
Reacción del agua con el oxígeno atmosférico fotocatalizada:
H2O + O2 → H+ + O2– + OH·
El radical hidroxilo, OH·, formado tanto en el paso 1 como en el paso 3, es un agente de gran poder oxidante debido a su inestabilidad (la presencia de un electrón desapareado inestabiliza mucho los compuestos, lo que los hace más reactivo). Así, el OH· puede reaccionar con el NO2, mientras que el anión superóxido, O2–, puede reaccionar con el NO:
NO2 + OH· → H+ + NO3–
NO + O2– → NO3–
Esta oxidación fotoquímica producida con la ayuda del dióxido de titanio (IV) es mucho más rápida que en condiciones atmosféricas normales (en las que no es apenas apreciable) gracias a la energía absorbida por la capa superpuesta sobre el asfalto y a que la reacción química tiene lugar de forma localizada en la superficie del bloque, lo cual obviamente facilita la reacción al posibilitar que se encuentren los reactivos.
Como vemos, en ambas reacciones químicas se obtiene nitrato, NO3–, como producto final, el cual permanece adsorbido en la superficie del asfalto y puede ser disuelto y arrastrado por las aguas de lavado y por las lluvias, eliminándose a través del alcantarillado que irán a parar a la depuradora.
1. La radiación ultravioleta es absorbida por el dióxido de titanio
2. Los óxidos de nitrógeno reaccionan con los iones superóxido y los radicales hidróxido para formar aniones nitrato.
3. Los aniones nitratos son absorbidos en el bloque o son lavados posterioremente con las lluvias para llegar al alcantarillado.
Más información:
[1] Real Decreto 1073/2002, de 18 de octubre, sobre evaluación y gestión de la calidad del aire ambiente en relación con el dióxido de azufre, dióxido de nitrógeno, óxidos de nitrógeno, partículas, plomo, benceno y monóxido de carbono.
[2] Ficha datos de seguridad del INSHT – Rutilo
Nanomateriales activos para la reducción de gases de combustión: Proyecto Fénix





