Leyes de los gases (III): Ley de Gay-Lussac
Escrito por Quimitube el 19 mayo
Ya vimos en entradas previas dos de las leyes fundamentales de los gases ideales, la ley de Boyle-Mariotte y la ley de Charles. La primera de ellas determina qué sucede con un gas cuando sufre una transformación de un estado 1 a un estado 2 a temperatura constante, mientras que la segunda, la ley de Charles, determina qué pasa con la temperatura y el volumen cuando lo que permanece constante es la presión. Como vemos, tratándose de tres variables fundamentales para los gases ideales, la presión, el volumen y la temperatura, era lógico que también se intentase dar respuesta a la pregunta siguiente: ¿Qué pasa con la presión y la temperatura de un gas ideal cuando mantenemos constante el volumen?
Así, Joseph Louis Gay-Lussac, a comienzos del siglo XIX, estudió precisamente esto, cómo varía la presión de un gas al modificar su temperatura, manteniendo constante el volumen. De esta forma observó que la presión y la temperatura son magnitudes directamente proporcionales; el cociente P/T permanece constante para un mismo volumen.
Así, se puede enunciar como: «La ley de Gay-Lussac establece que, cuando un gas experimenta una transformación a volumen constante, el cociente de la presión ejercida por la temperatura del gas permanece constante», es decir:
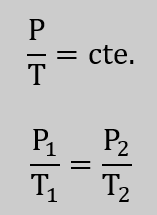
Así, cuando un gas ideal en un émbolo pasa de un estado 1 a un estado 2, manteniéndose constante el volumen, aumentará la presión si también aumenta la temperatura:
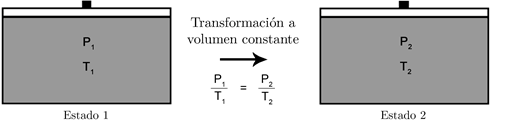
Recordad que, en las leyes de los gases, la temperatura debe usarse en kelvin, mientras que la presión y el volumen se pueden expresar en la unidad que deseemos, siempre y cuando usemos la misma para los dos estados considerados.
En una entrada posterior combinaremos las tres leyes de los gases que hemos visto, la ley de Boyle-Mariotte, la ley de Charles y la ley de Gay-Lussac para deducir la ecuación general de los gases ideales o ecuación de estado de un gas ideal.
También te puede interesar:
Leyes de los gases(I): ley de Boyle-Mariotte
Leyes de los gases(II): ley de Charles
¿Podemos predecir con cálculos si un gas será más denso que el aire?




